很多朋友在做醫療器械CE認證時,會對檢測和驗證的內容不是很清楚,今天小編就在這里給大家整理了詳細的檢測和驗證內容,一定要收藏哦!

一,性 能 檢 測
(1)產品性能檢測
依據產品標準或者技術要求,對產品進行的全性能檢測。
接骨板:材料,機械性能,表面質量,尺寸,靜態四點彎曲,疲勞四點彎曲。
接骨螺釘:材料,機械性能,表面質量,尺寸,螺釘旋入旋出,扭轉,自攻,靜動態四點彎曲。
(2)選樣說明
一般選擇最具代表性,最差情況型號進行檢測。如果一個型號無法覆蓋,需測試2個或者多個型號。
(3)測試機構
如果企業有設備有能力檢測,可以企業自測。否則就找有資質的第三方測試。
二,生 物 相 容 性
(1)生物相容性檢測
根據ISO10993-1:2018 附錄A,骨科植入物需要檢測的項目有:細胞毒,致敏,刺激,熱原,急性全身毒性,亞急性毒性,亞慢性毒性(15/30周),慢性毒性,植入反應(30/60周),遺傳毒性,致癌性。
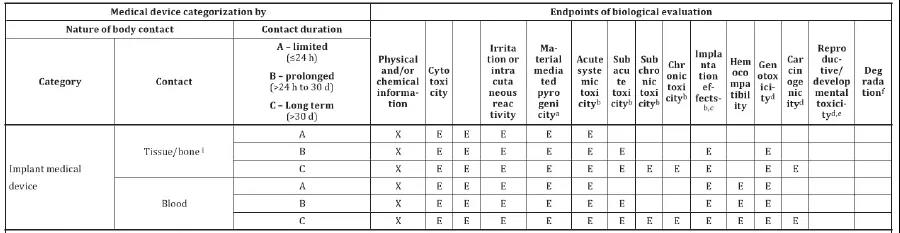
(檢測成品)
評估可以包括對相關的現有臨床前和臨床數據以及實際測試的回顧。這樣的評估可能得出這樣的結論:如果該材料具有可證明的安全使用歷史,并且具有與設計中的醫療設備相同的指定作用和物理形式,則無需進行測試。可以證明等效性的信息類型包括在附錄B中。當已經有足夠的信息來對材料和/或醫療器械進行風險評估時,通常不必進行測試。
三,特 殊 過 程 驗 證
特殊過程:以下情況之一的,可以認定為特殊工序或過程:
(1)不能通過后續的監視和測量加以驗證,或即使能夠驗證,但產生的不合格不能糾正的過程;
(2)過程的產品不能快速、經濟的直接進行驗證,或需要經破壞性試驗或采用較復雜或成本較高、試驗周期較長的方法才能測量,或只能通過間接的監控的過程;
(3)測過程的產品只有在產品使用或交付后,不合格的質量特性才暴露出來的過程
生產過程中特殊過程有內包裝封口驗證,滅菌驗證,清洗驗證等。
封口驗證
即對封口參數(溫度,壓力,時間/速度)的驗證。
滅菌驗證
如果產品為無菌提供,需對整個滅菌過程進行驗證;如果產品為非無菌提供,由醫院使用前滅菌,則說明書中需提供已驗證的滅菌參數。
無菌提供產品:生產商需對整個滅菌過程進行驗證,包括IQ, OQ和PQ。
EO滅菌:EN ISO 11135: 2014
輻射滅菌:EN ISO 11137-1: 2015/A2:2019, EN ISO 11137-2: 2015
包括劑量設定和劑量分布,確定最大輻照劑量,有效期驗證的樣品應先用最大劑量輻照。生物負載監測,劑量審核。
濕熱滅菌:EN ISO 17665-1:2006,EN ISO 17665-2:2009
干熱滅菌:ISO 20857:2010
需定期進行再驗證,通常是每年要再驗證。產品的變更、滅菌設施和工藝的變更、其他可能對驗證造成影響的情況也需進行再驗證。
如企業自己滅菌,相關檢測,驗證和再驗證將是審核重點。如委外滅菌需要選擇有資質的滅菌站,簽訂滅菌協議。也需按照體系要求對滅菌公司進行供應商審核。
滅菌控制程序:滅菌驗證,常規滅菌控制,產品放行,再驗證
非無菌提供使用前滅菌的產品:需對說明書中列明的滅菌參數進行驗證。注意:應該使用歐洲常用的滅菌參數。

鑒于對蒸汽滅菌的成熟認識,標準以及實踐已經不再要求做微生物測試,只需要通過物理方法證明產品內外表面都能夠達到滅菌條件即可。驗證過程需做三次循環。
接收標準:以預真空 134 ℃, 3min 蒸汽滅菌為例
◆ 滅菌溫度范圍:134~137 ℃
◆ 中小型滅菌器平衡時間應小于15s,大型滅菌器應小于30s。
◆ 所有溫度測量點都應在134~137℃溫度范圍內,并且不同點間最大溫度差不大于2℃。
◆ 全周期中滅菌保持時間要不小于3min。
清洗驗證
包括生產過程的清洗驗證和醫院使用前的清洗消毒驗證。
生產過程的清洗驗證: 骨科植入物驗證依據 ISO 19227,接收標準包括:目視檢查,生物負載,微粒污染,細胞內毒性,有機污染物,無機污染物,細胞毒性。
選樣說明:選擇結構復雜,較難清洗的產品為代表產品。
清洗參數:水溫,水量,清洗時間,是否添加清洗劑,烘干溫度,烘干時間。
使用前的清洗消毒驗證:驗證依據:ISO 17664, ISO 15883-1, -2, -5. 接收標準:
1.檢測液中無可視殘留物。
2.清洗后的器械上最大蛋白質含量應低于下面表格中的行動線要求。

四,包 裝 及 有 效 期 驗 證
包裝驗證即無菌屏障系統驗證:依據ISO11607-1/-2, 驗證項目:
(1)包裝材料與成型和密封過程的適應性;
(2)包裝材料與預期滅菌過程的適應性;
(3)包裝材料與標簽系統的適應性;
(4)包裝材料與貯存運輸過程的適應性;
(5)包裝材料的微生物屏障特性;
(6)包裝材料的生物相容性特性;
(7)包裝材料的物理化學性能;
注意:無菌產品或者使用前滅菌的產品的內包材需在潔凈室生產,需要供應商提供潔凈室檢測報告。
有效期驗證:包括包裝有效期和產品有效期,因此需同時驗證包裝和產品的有效期。可以實時老化和加速老化。
(五)關 鍵 工 序 驗 證
關鍵工序:一般來說,以下情況之一的,應該被認定為關鍵工序:
(1)對產品質量、特性、功能、壽命、可靠性及成本等有直接影響的工序;
(2)產品重要或關鍵特性形成的工序;
(3)工藝復雜、質量容易波動、對人員技能、設施能力、環境條件要求較高,或以往生產過程中發生問題較多的工序;
(4)若控制不好,可能存在產品質量隱患的工序;
(5)存在環境污染和人員職業健康安全隱患或風險的工序。
所有特殊過程和關鍵工序的驗證,都必須有詳細的驗證方案和驗證報告,并且驗證報告中需附上原始記錄。再驗證要求和頻次,需在驗證方案和報告中寫明。
MDR法規下醫療器械CE認證---檢測和驗證內容