捷報頻傳辭歲去,宏圖再展迎春來。乙巳年大年初一,大家正沉醉在春節的喜慶氣氛中。從美國食品藥品監督管理局(FDA)傳來好消息,國內激光手術器械類企業的CO?激光治療儀已順利通過美國FDA-510k的審評,收到美國食品藥品監督管理局FDA-510k批準信,意味著該產品可以在美國市場合法經銷。為國產醫療器械制造商公司在光療器械和美容器械的國際發展打下了堅實基礎。
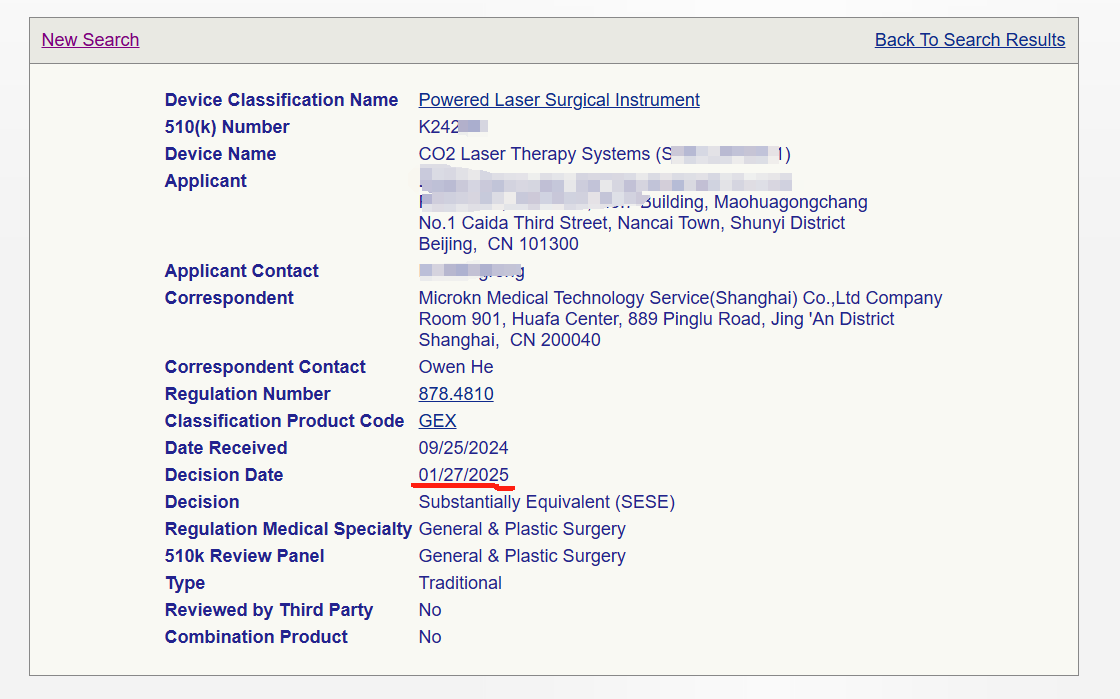
關于產品:
二氧化碳激光是一種氣體激光,波長為10.6μm ,它可以讓組織氣化而達成治療的目的。主要治療:血管性皮膚病,色素性皮膚病,惡性腫瘤,良性腫瘤或囊腫,角化、增生及其他皮膚病等。這次獲批的CO2激光治療儀用于皮膚科、整形外科和普通外科的軟組織消融、蒸發、切除和凝固。
項目回顧:
微珂咨詢技術團隊精準把控FDA的法規要求,抓住審核要點,在短時間內高質量高效率完成eSTAR文件的編制。該項目于2024年9月25日遞交,在FDA的審評過程中,微珂的技術團隊迅速反應,在短時間內有效輔導企業進行整改。從遞交到通過,總共僅花費4個月的時間。該項目成功的背后離不開制造商技術團隊的鼎力支持,高效配合,為快速取證贏得了時間。
什么是FDA-510k ?
FDA-510K,是美國食品、藥品和化妝品(FD&C)行動委員會的一個法案章節,而這個法案的章節,正好是在美國FD&C Act第510章節,所以很多人習慣性的把他稱作是510K,而且這個是美國食品、藥品和化妝品(FD&C)行動委員會法案,所以大家又都喜歡叫它做FDA510K,這就是所謂的FDA510K的由來。
因為根據這個510K章節的法案要求,凡是把一些規定的器械引入美國市場,都要求滿足這個法案,那些不豁免510k的I類或II類或III類醫療器械,都必須做“產品上市登記”。所以這個產品上市登記,就是通常我們俗稱的FDA510(K)。
微珂服務集團,成立十年,致力和引領醫療器械注冊服務、法規咨詢、質量體系、測試等各領域,已形成醫療器械企業提供一站式、深入、全面、定制式技術咨詢服務。
本次項目的順利完成背后離不開雙方親密無間的默契合作,感謝制造商項目組全體成員高度重視和高效配合,加上微珂咨詢高效優質負責的法規服務,雙方協力齊心,共創佳績。最終助力制造商成功邁出了敲開美國國際市場大門的堅實一步。
微珂將協助您完成FDA及510k的全程輔導,并讓您的產品最終獲得美國FDA的批準,獲得進入美國市場的入場券。