MDR于今年5月26日已經正式實施,對于MDR條款33中要求建立的UDAMED數據庫,想必關于歐盟新法規的人都不算陌生。UDAMED數據庫中的經濟運營商注冊模塊已向公眾開放,不少制造商已經申請了SRN號。
UDAMED數據庫的六大模塊的建立主要是促進 1)MDR 下有關相關經濟運營商注冊(參與者注冊);2)設備和系統和程序包 (UDI);3)公告機構和證書;4)符合性評定;5)臨床調查;6)警戒和市場監督以及上市后的監督。
UDAMED數據庫全部功能預期2022年5月與IVDR正式實施時同步開放,但是MDR已經與2021年5月26日正式實施,在這個過渡期內,相關方同樣需要考量UDAMED數據庫。具體如何執行,MDCG發布了指南文件MDCG-2021-1。針對這份指南,我們用兩篇推文進行完整的解讀。這篇推文主要解讀這個指南文件對過渡期的整體要求,下一篇推文則解讀每個模塊的具體要求。
MDR條款規定的與UDAMED數據庫相關的活動主要如下:


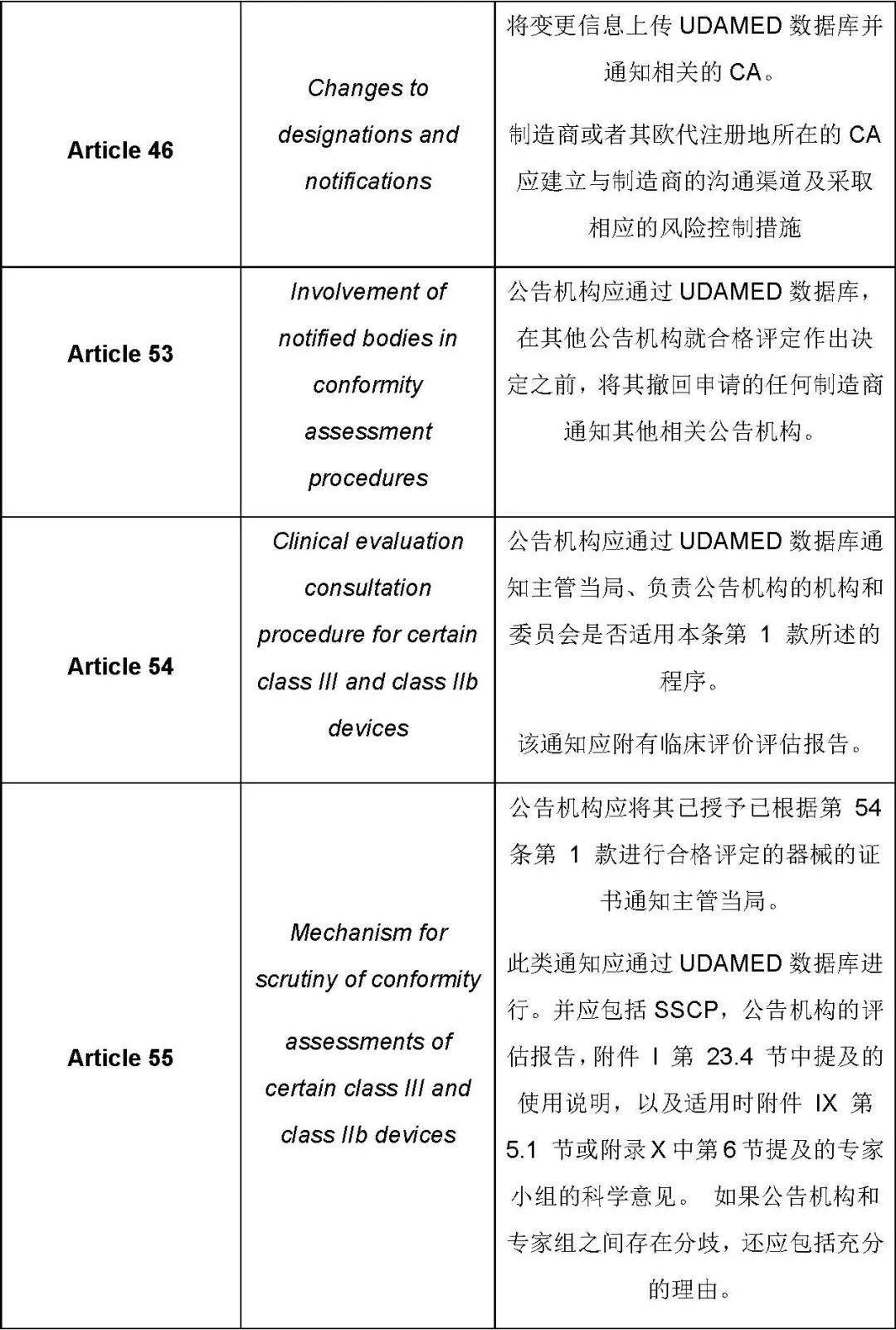
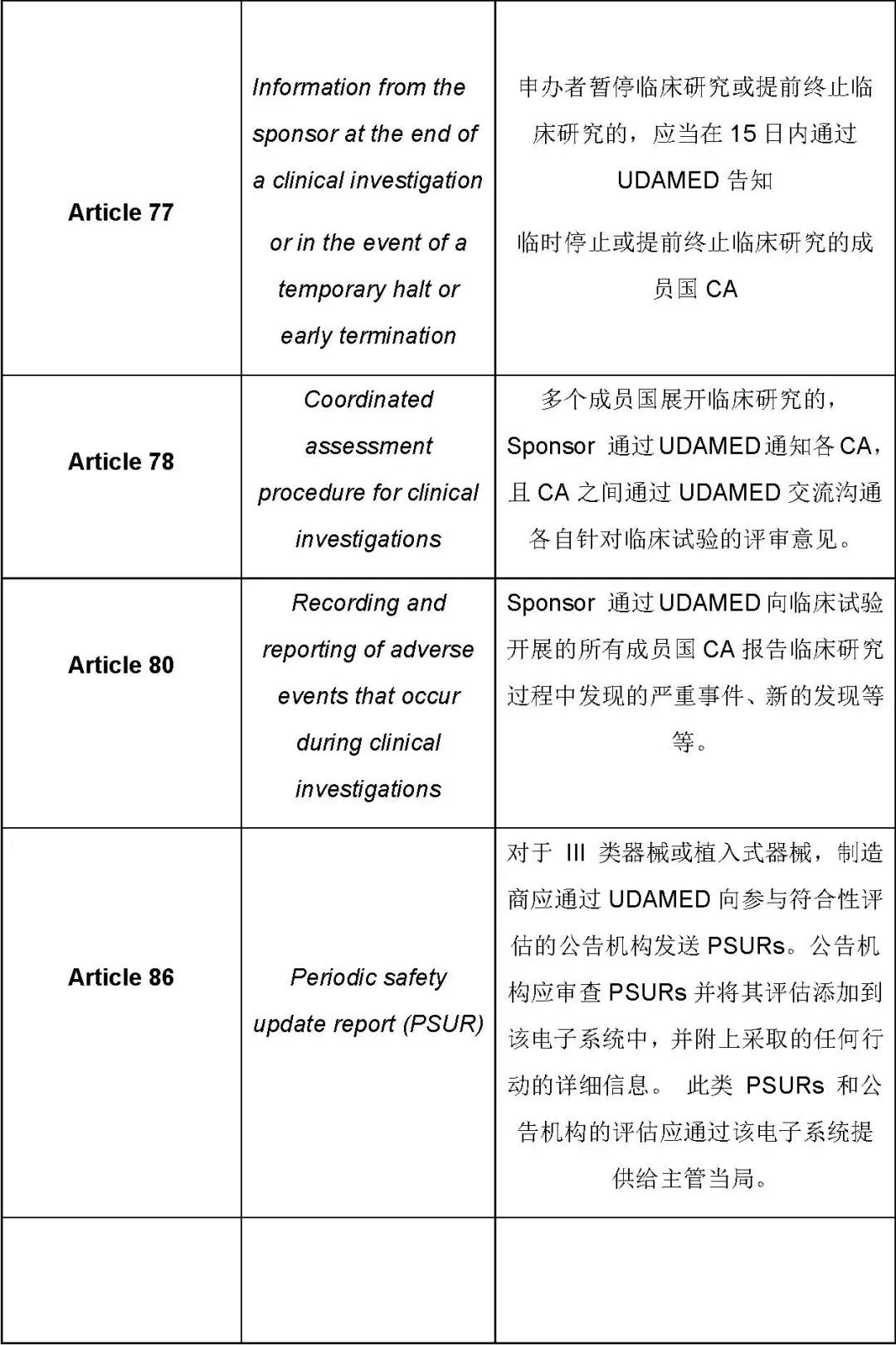

這篇文章僅羅列出來了與UDAMED數據庫有關的條款及總體要求。基于這些要求,制造商需要思考的是哪些是直接與制造商相關的,哪些是間接相關的,制造商應該怎樣配合相關方執行與UDAMED相關的過程。識別出來所有相關的過程后,應通過建立程序文件、SOP等把這些過程納入質量管理體系,相關的人員依據質量管理體系的要求執行相關的活動,這樣才能確保法規的要求不會遺漏。下一篇文章我們將重點講解過渡期內針對每項要求MDCG推薦的替代性解決方法以及如何將要求及方法轉化到質量管理體系,歡迎持續關注微珂咨詢。