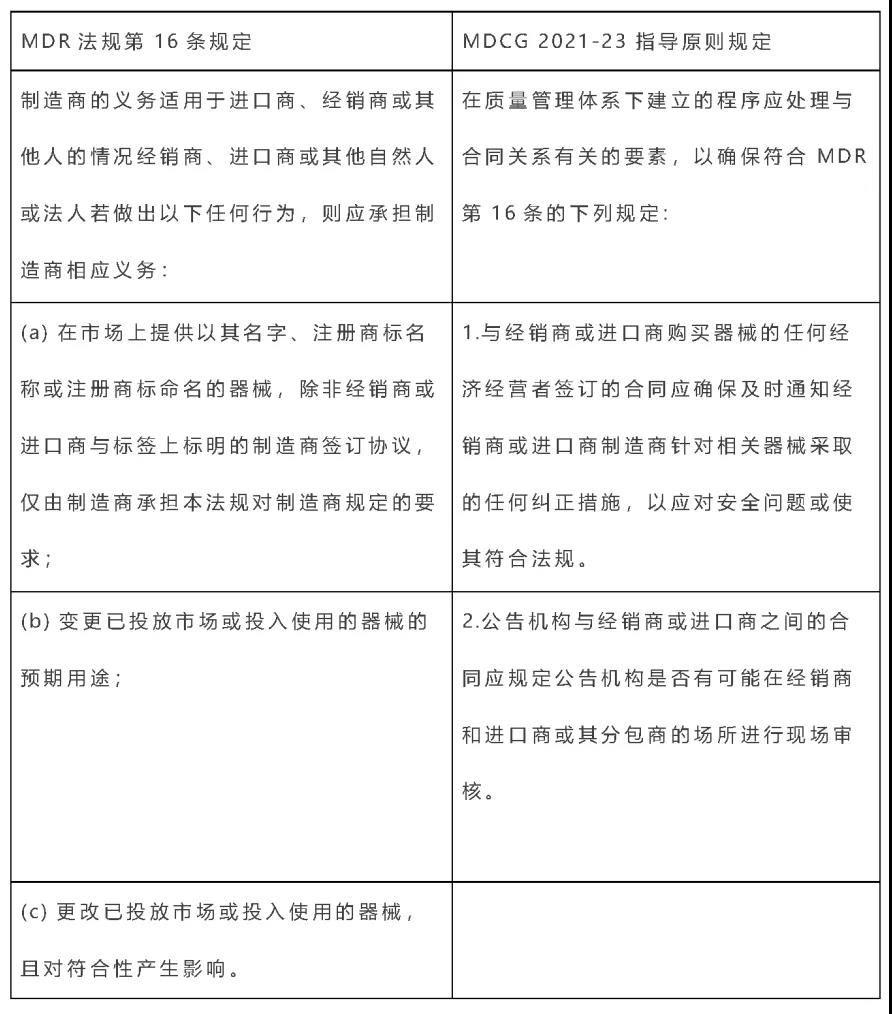
上周,MDCG發(fā)布了2021-23指南文件。對于(EU) 2017/745 (MDR)法規(guī)的第16(4) 條:制造商的義務適用于進口商、經(jīng)銷商或其他人的情況,該指南給公告機構提供了一份指導,要求公告機構建立必要的評估活動。同時也為三級經(jīng)濟運營商升級到制造商的認證路徑(即:分銷商和進口商提供的MDR認證申請)做了澄清和指導。對于廣大的醫(yī)療器械貿(mào)易公司、進口商及經(jīng)銷商,并以Re-labeling或Re-package經(jīng)銷醫(yī)療器械的企業(yè),滿足質(zhì)量管理體系要求,承擔制造商的義務,并取得公告機構的認證。
質(zhì)量管理體系應至少涵蓋并解決以下問題:
01
管理體系的文件,包括管理層的責任,以及政策和程序的制定
02
資源管理,包括開展第 16 條第 (2) 款 (a) 和 (b) 點所述活動所需的場所和器械,以及供應商和分包商的選擇和控制
03
確保經(jīng)銷商或進口商獲悉制造商為應對安全問題或使其符合法規(guī)而采取的與相關器械相關的任何糾正措施的程序(第 16 條第 2 款 (a) 項和 (b)項)
04
糾正措施的管理,包括處理因第 16(2) 條 (a) 和 (b) 點開展的活動導致的不合格器械和市場召回的程序,包括必要時的現(xiàn)場安全糾正措施和有效性驗證
05
確保器械可追溯性的程序以及表明對產(chǎn)品所做更改的標簽、使用說明和外包裝
06
文檔控制
07
記錄控制
08
監(jiān)督質(zhì)量管理體系的實施和維護,包括內(nèi)部審核和管理審查
質(zhì)量管理體系應能夠支持和證明符合第16(3)條MDR / IVDR要求的一致性。
MDCG 2021-23詳細指導文件






