MDR認證法規下的驗證與確認實施及追溯分析
實施
風險管理以設計輸入要求的開發開始。隨著設計的進展,新風險可能會變得明顯。為了系統
地識別并在必要時降低這些風險,將風險管理過程整合到設計過程中。通過這種方法,如果變更
更易于制作并且成本較低,可以在設計過程的早期識別和管理不可接受的風險。
例如
一個將曝光控制系統用于通用x射線系統: 如果將控制功能分配給軟件,在開發過程后期,
系統的風險分析揭示了可能導致患者過度暴露的幾種失效模式。由于在設計接近完成之前尚未識
別到問題,因此必須添加昂貴且獨立的備用計時器來監控曝光時間。
1.基于風險分析、法規、標準、客戶需求、通用規格等形成完整的需求規格。
2.設計
3.實施設計驗證及設計確認
以無菌屏障系統驗證和確認為例:
1. 用戶的需求
●無菌保障水平10-6
●產品的貨架壽命5年
●如何實現:(識別所要遵從的EN標準、ISO標準或者其他標準)
●通過原材料的清洗、在潔凈環境中生產控制初始污染菌。
●采用最終產品滅菌。
●選擇質量與滅菌工藝匹配的包裝材料。
●選擇合適的密封工藝
2. 設計驗證:
●初始污染菌的檢測;
●包裝材料的來料檢驗;
●熱合后包裝密封強度、染色液滲透、外觀檢測;
●無菌包裝老化后包裝性能檢驗;
●產品老化后性能檢驗 (無菌、滅菌劑殘留、熱原、內毒素和熱原等)
3.設計確認:
●通過分析原材料初始污染菌、包裝材料初始污染菌、熱合后的包裝性能、滅菌及老化后的包裝性能、老化后的包裝性能及產品性能結果、熱合工藝驗證結果、滅菌工藝驗證結果、制造環境監測結果等確認在規定的制造環境和工藝下,采用經驗證的原材料可持續的生產出滿足用戶需求的產品。(僅指無菌屏障能力滿足用戶需求,無菌保障水平10-6,貨架壽命5年)。
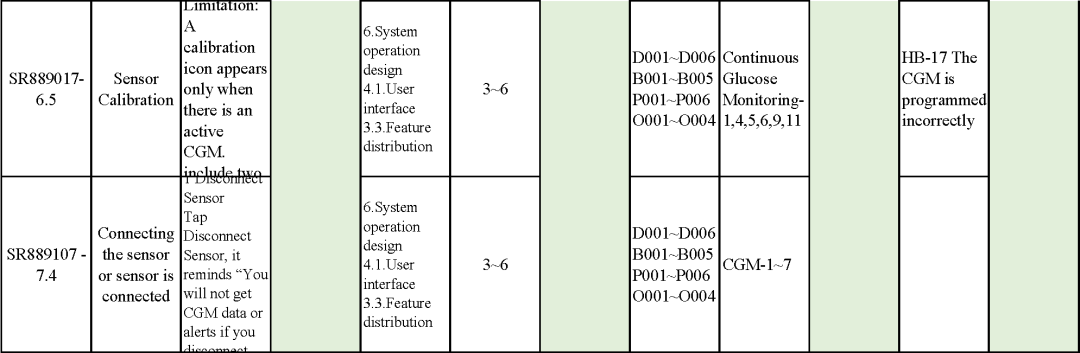
追溯分析
確保需求都已實現、產品滿足客戶需求或者其預期用途
追溯示例
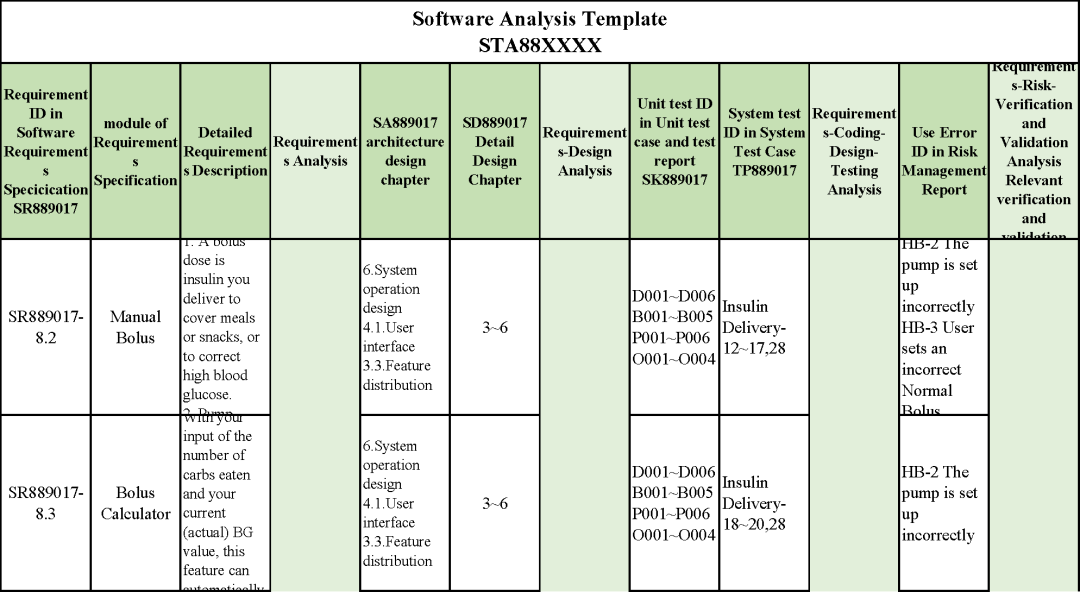
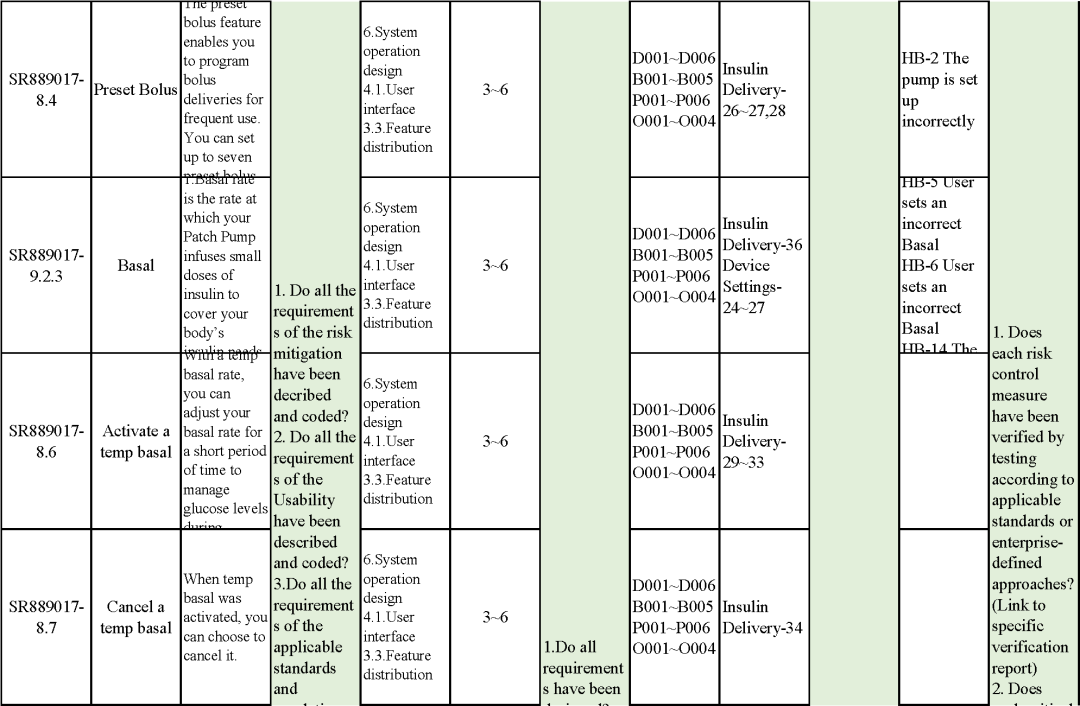
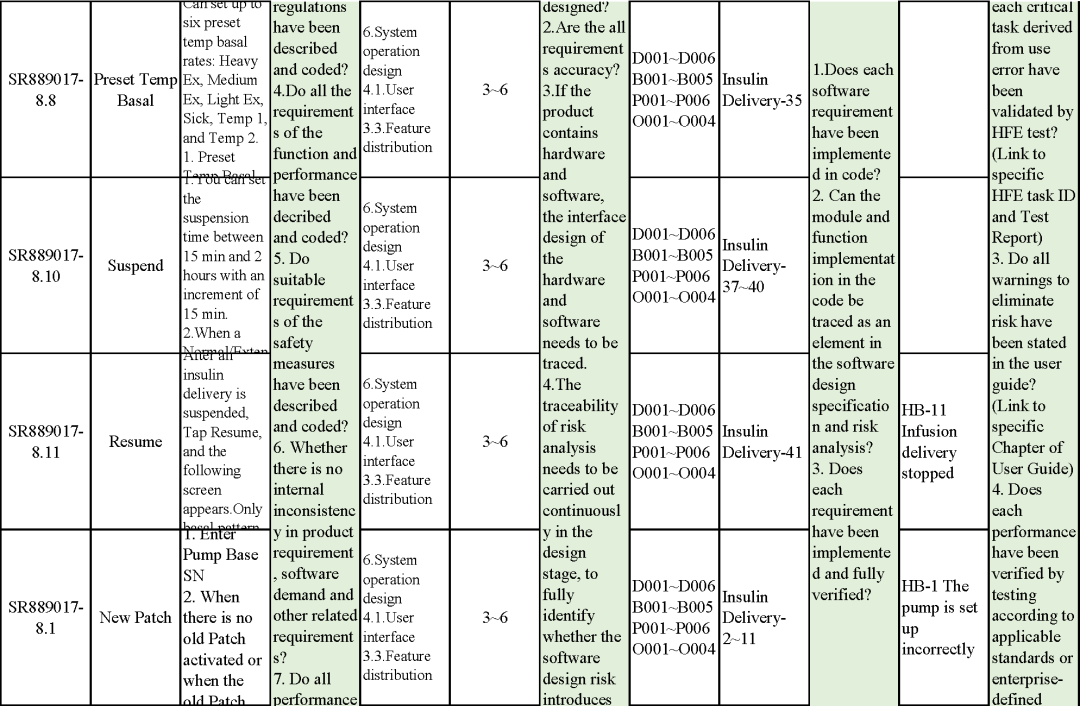
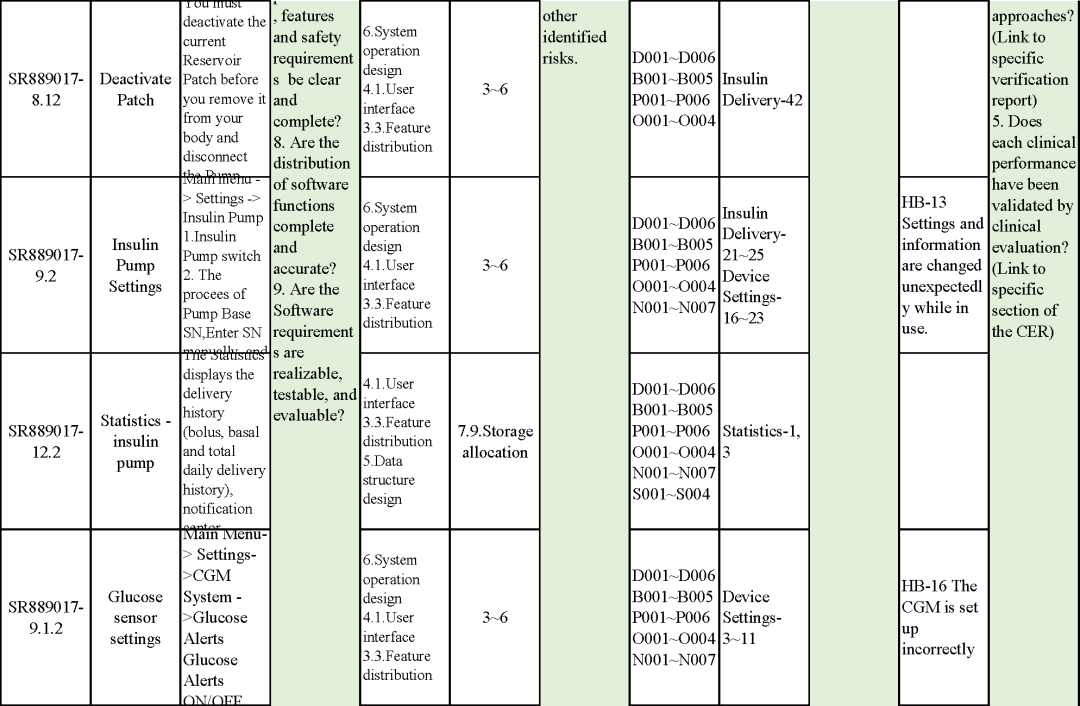
微珂提供專業的MDR/IVDR認證服務,歡迎來電咨詢:
微珂醫藥擁有海內外專業成熟的技術團隊、以及與機構深度的戰略合作,服務于醫療器械企業,為企業提供優質的定制化服務,協助企業從產品技術要求編寫、產品檢測、臨床評價資料編寫與審核、申報與跟蹤,根據企業實際情況,進行質量管理體系建立,幫忙企業從管理到產品各環節一站式服務!
微珂集團服務熱線:400-118-2826!