
歐洲委員會(huì)于當(dāng)?shù)貢r(shí)間2024年1月23日,發(fā)布最新提案:建議歐洲議會(huì)和理事會(huì)的規(guī)定修訂MDR(歐盟醫(yī)療器械法規(guī))和 IVDR認(rèn)證(體外診斷器械法規(guī)),關(guān)于EUDAMED的逐步推出、供應(yīng)中斷時(shí)的信息義務(wù)和某些體外診斷醫(yī)療器械的過渡性規(guī)定。
本提案要解決的3個(gè)緊迫問題如下:
●IVDR最新延期提案
根據(jù)指令98/79/EC頒發(fā)并根據(jù)本條第2段有效的證書的設(shè)備可以在2027年12月31日之前投放市場或投入使用。
符合98/79/EC指令的合格評(píng)定程序不需要公告機(jī)構(gòu)參與的設(shè)備,其符合性聲明是在2022年5月26日之前根據(jù)該指令起草的,并且符合本法規(guī)的合格評(píng)定程序需要公告機(jī)構(gòu)參與的設(shè)備,可以在以下日期之前投放市場或投入使用:
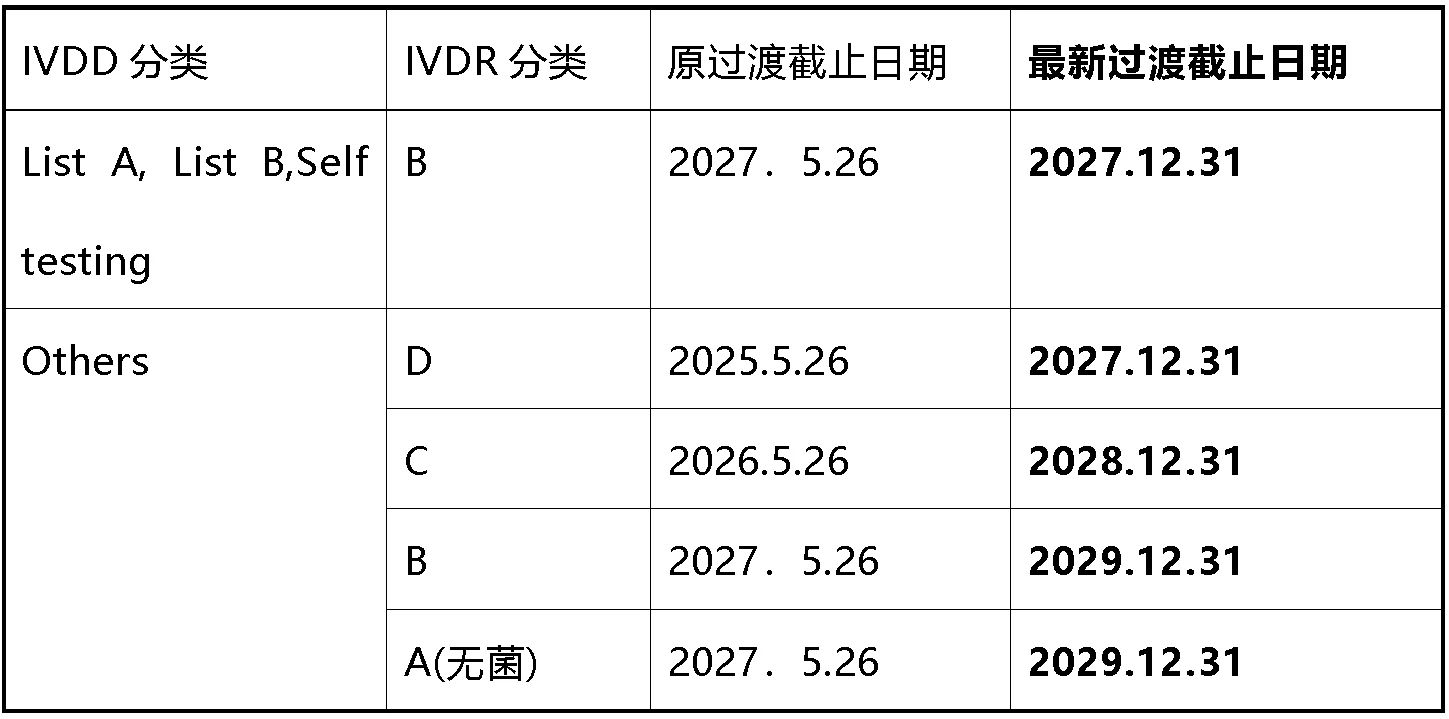
原文參考如下:

●EUDAMED的逐步推出
逐步推行已經(jīng)集成到歐洲醫(yī)療器械數(shù)據(jù)庫EUDAMED的模塊的使用,而不用等所有模塊開發(fā)全部完成。EUDAMED的使用,特別是對于設(shè)備和證書注冊,經(jīng)濟(jì)運(yùn)營商的信息,將有助于提高透明度及監(jiān)控設(shè)備的可用性。
●供應(yīng)中斷時(shí)的信息義務(wù)
該提案旨在規(guī)定制造商有義務(wù)在暫時(shí)或永久停止供應(yīng)關(guān)鍵設(shè)備之前通知其相關(guān)主管當(dāng)局和衛(wèi)生機(jī)構(gòu)。如果制造商不直接向衛(wèi)生機(jī)構(gòu)或衛(wèi)生保健專業(yè)人員供應(yīng),則應(yīng)通知供應(yīng)鏈中的相關(guān)經(jīng)濟(jì)經(jīng)營者,由其通知衛(wèi)生部門。