近日,喜訊連連,由微珂咨詢牽頭并共同參與的項目從FDA接受資料開始評審到批準,前后62天,一次性通過。
新年新希望,喜報連連到。20242月最后一周,從FDA官網獲悉,由微珂作為咨詢公司助力的越凡醫療公司經皮神經電刺激器Transcuataneous electrical nerve stimulation(簡稱TENS)項目成功獲美國食品藥品監督管理局(FDA)510k批準,意味著該產品可以在美國市場合法經銷。
寧波越凡醫療科技有限公司(WAT Med)是一家致力于創新個人用醫療設備的制造商。核心團隊由多名海外專家組成,是寧波市“3315”計劃重點引進的海外創新創業團隊。

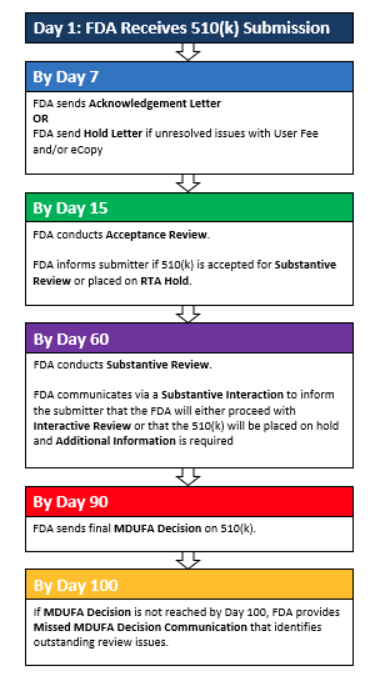
什么是FDA-510k ?
FDA-510K,是美國食品、藥品和化妝品(FD&C)行動委員會的一個法案章節,而這個法案的章節,正好是在美國FD&C Act第510章節,所以很多人習慣性的把他稱作是510K,而且這個是美國食品、藥品和化妝品(FD&C)行動委員會法案,所以大家又都喜歡叫它做FDA510K,這就是所謂的FDA510K的由來。
因為根據這個510K章節的法案要求,凡是把一些規定的器械引入美國市場,都要求滿足這個法案,那些不豁免510k的I類或II類或III類醫療器械,都必須做“產品上市登記”。所以這個產品上市登記,就是通常我們稱做的FDA510(K)注冊。
微珂服務集團,成立九年,致力和引領醫療器械注冊服務、法規咨詢、質量體系、測試等各領域,已形成醫療器械企業提供一站式、深入、全面、定制式技術咨詢服務。
本次項目的順利完成背后離不開雙方親密無間的默契合作,感謝制造商項目組全體成員高度重視和高效配合,加上微珂咨詢高效優質負責的法規服務,雙方協力齊心,共創佳績。最終助力制造商成功邁出了敲開美國國際市場大門的堅實一步。
微珂將協助您完成FDA及510k的全程輔導,并讓您的產品最終獲得美國FDA的批準,獲得進入美國市場的入場券。