四月最美,春暖花開(kāi),捷報(bào)頻傳,喜訊不斷!2024年4月初,從公告機(jī)構(gòu)TUV萊茵傳來(lái)喜訊,有微珂全程輔導(dǎo)的IIa類(lèi)理療醫(yī)療器械順利獲得CE-MDR批準(zhǔn)上市,標(biāo)志著該產(chǎn)品在CE認(rèn)證適用國(guó)家正式邁入商用階段,制造商可順利進(jìn)軍海外市場(chǎng),推進(jìn)產(chǎn)品全球化上市。
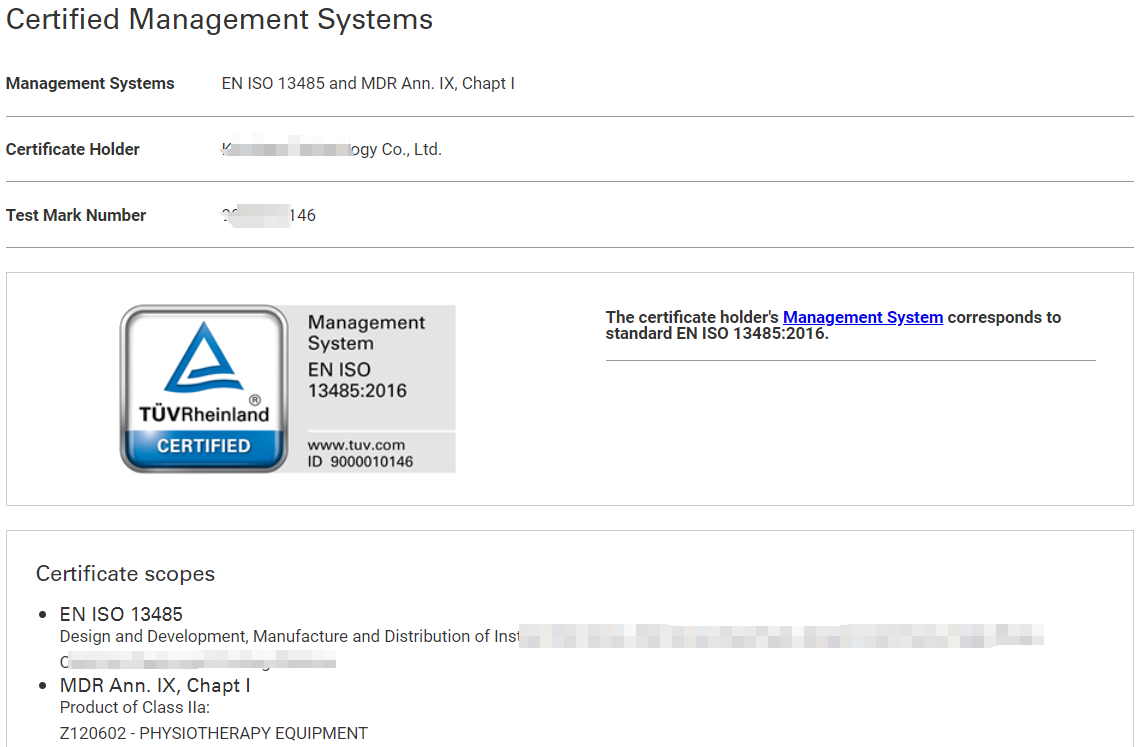
CE-MDR證書(shū)是歐洲共同體頒發(fā)的產(chǎn)品質(zhì)量標(biāo)志,它不僅是對(duì)產(chǎn)品安全性和符合性的一種認(rèn)證,更是打開(kāi)歐洲市場(chǎng)大門(mén)的重要通行證。
微珂咨詢(xún)(Microkn)可提供的MDR認(rèn)證咨詢(xún)的相關(guān)服務(wù)有:MDR法規(guī)下CE技術(shù)文檔建立,MDR法規(guī)下臨床評(píng)價(jià)及整改,MDR法規(guī)下質(zhì)量管理體系輔導(dǎo),以及一系列專(zhuān)業(yè)的培訓(xùn)和技術(shù)服務(wù),整個(gè)項(xiàng)目進(jìn)程和服務(wù)受到了制造商的高度認(rèn)可。
在本項(xiàng)目中,微珂全程參與了該項(xiàng)目的咨詢(xún)工作,重點(diǎn)包括培訓(xùn)、文件制修訂、模擬審核等。微珂與制造商首先就產(chǎn)品功能和性能深入分析,結(jié)合法規(guī)深入逐項(xiàng)進(jìn)行臨床評(píng)價(jià)、風(fēng)險(xiǎn)管理、質(zhì)量管理體系等重點(diǎn)工作,討論確定設(shè)計(jì)臨床評(píng)價(jià)方案和臨床文獻(xiàn)檢索方案,結(jié)合上市后不良事件和臨床數(shù)據(jù)中的安全事件更新風(fēng)險(xiǎn)分析,使用SOTA數(shù)據(jù)和等同器械的文獻(xiàn)數(shù)據(jù)支持滿足器械的臨床評(píng)價(jià)終點(diǎn)。基于對(duì)MDR法規(guī)及產(chǎn)品有深入的理解和分析,在臨床評(píng)價(jià)(等同對(duì)比、文獻(xiàn)檢索、文獻(xiàn)評(píng)估、臨床數(shù)據(jù)分析)能夠更準(zhǔn)確的輸出。通過(guò)豐富高效的服務(wù)流程,大大提高項(xiàng)目實(shí)施效率,針對(duì)臨床評(píng)價(jià)、風(fēng)險(xiǎn)管理等這些專(zhuān)題,充分識(shí)別要求,直接高效的給出解決方案,項(xiàng)目得以順利的提交、審核、整改、獲得證書(shū)。
微珂咨詢(xún)(Microkn)資深技術(shù)團(tuán)隊(duì)與制造商項(xiàng)目組密切配合,經(jīng)過(guò)雙方共同的不懈努力,接受了公告機(jī)構(gòu)TUV萊茵審核團(tuán)隊(duì)及臨床評(píng)審專(zhuān)家團(tuán)隊(duì)的嚴(yán)格審核,最終順利通過(guò)MDR認(rèn)證。在本次輔導(dǎo)項(xiàng)目中,微珂技術(shù)團(tuán)隊(duì)展現(xiàn)出扎實(shí)的法規(guī)能力,敏銳的合規(guī)意識(shí),針對(duì)項(xiàng)目期間的發(fā)補(bǔ)和整改方向進(jìn)行專(zhuān)項(xiàng)突破,步步為營(yíng),最終順利通過(guò)TUV萊茵機(jī)構(gòu)審核并取得MDR法規(guī)下CE證書(shū),可喜可賀!
該項(xiàng)目的順利進(jìn)行,充分體現(xiàn)了微珂項(xiàng)目組定制式服務(wù)的優(yōu)勢(shì),通過(guò)項(xiàng)目組和制造商團(tuán)隊(duì)的精誠(chéng)合作,最終產(chǎn)品順利獲得CE MDR認(rèn)證。經(jīng)過(guò)這個(gè)項(xiàng)目的全流程后,微珂的團(tuán)隊(duì)對(duì)于承接理療類(lèi)CE MDR項(xiàng)目更具信心了。同時(shí)也要感謝TUV萊茵公司審核專(zhuān)家,他們通過(guò)敬業(yè)和嚴(yán)謹(jǐn)?shù)墓ぷ鳎约把附莸捻?xiàng)目管理和發(fā)證速度,為中國(guó)醫(yī)療器械企業(yè)助力護(hù)航,邁出了敲開(kāi)歐盟國(guó)際市場(chǎng)大門(mén)的堅(jiān)實(shí)一步。