自從英國脫歐之后,討論醫療器械的英國銷售,不可避免需要提到MHRA。
MHRA中文名稱為藥品和醫療保健產品監管局,是英國負責醫療器械和藥品法規的機構。MHRA成立于2003年,其總部位于英國倫敦。在英國脫歐后,醫療器械在英國的上市前和上市后的監管都由MHRA主管,其性質類似于我國的政府監管機構NMPA(國家藥品監督管理局)或者美國FDA(美國食品藥物管理局)。
雖然英國脫歐已經有幾年了,但距離MHRA全面接管歐盟CE,還是需要經歷相當長一段時間,MHRA官方給出的計劃是到2030年。

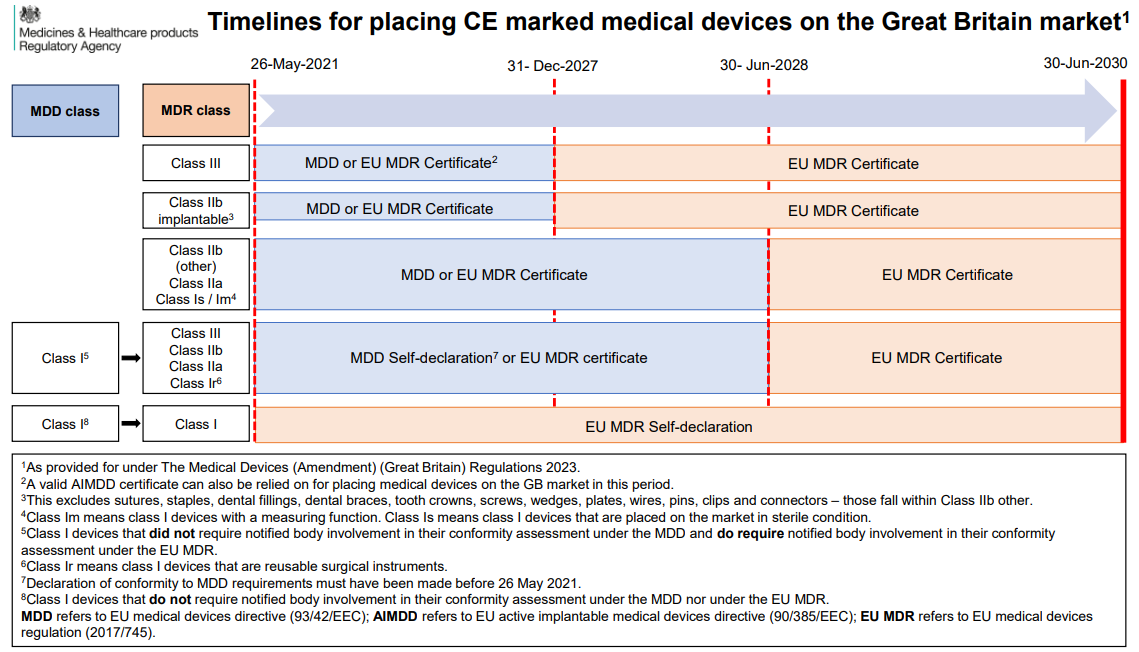
對于已有CE注冊的醫療器械產品,MHRA提供了寬限期進行注冊,具體可以參考微珂2024年1月18日的推文:【微珂解讀】英國MHRA更新帶CE標志的醫療器械投放英國市場的時間表! (qq.com)
MHRA新規規定,醫療器械產品在英國 (英格蘭、威爾士和蘇格蘭)進行銷售前必須在MHRA完成注冊,

在英國市場銷售,需要注冊的產品包括:
● 醫療器械
● 體外診斷器械(包括所有正在進行性能評估的)
● 定制器械
● 系統和程序包
英國境外的制造商,如果想要完成MHRA注冊,必須先指定英代,然后由其代為完成注冊,英代的概念和大家較為熟悉的歐代(歐盟授權代表)相似,英代也作為英國法規合規負責人的角色參與到注冊過程中。
新規下英國醫療器械注冊,對于制造商和供應商的要求:
●規定了從事醫療器械業務的實體的要求和責任有關,包括在英國分銷醫療器械的醫療器械制造商和供應商。
●落實變更通知義務,以下任何變更應及時通知MHRA
a. 注冊地址
b. 公司名稱
c. 公司類型(法律形式)
d. 設備列表(例如設備變更或設備增加)
e. 體外診斷醫療設備的狀態
f. 授權代表更換
如果您對英國MHRA注冊有任何困難,歡迎聯系微珂集團!