醫療設備是全生命周期管理,多個法規和標準對上市后的監督提出了相應的要求,比如:
(1) MDR法規第83條要求制造商建立上市后監督系統。其目的是積極地系統地收集、記錄和分析器械在整個生命周期內的質量、性能和安全性的相關數據,并得出必要的結論,并確定、實施和監測任何預防和糾正措施。
(2)依據 ISO 13485:2016 第5.6條,組織應定期開展管理評審,評價質量管理體系的適宜性、充分性和有效性。
依據ISO 13485:2016 第8.2條、8.4條、8.5條,組織應實施監視、測量、分析和改進,以達到如下目的:
a) 證明產品的符合性;
b) 確保質量管理體系的符合性;
c) 保持質量管理體系的有效性。
(3)依據ISO 14971:2019第10條,制造商應選擇合適的方法積極地收集和評審生產和生產后的信息,確保產品和過程滿足監視和測量的要求,確保在實際應用環境下產品的剩余風險是可接受的。
標準ISO TR 20416的出臺則為制造商和其經濟運營商制定上市后監督計劃,持續積極的收集和分析數據提供了指導。
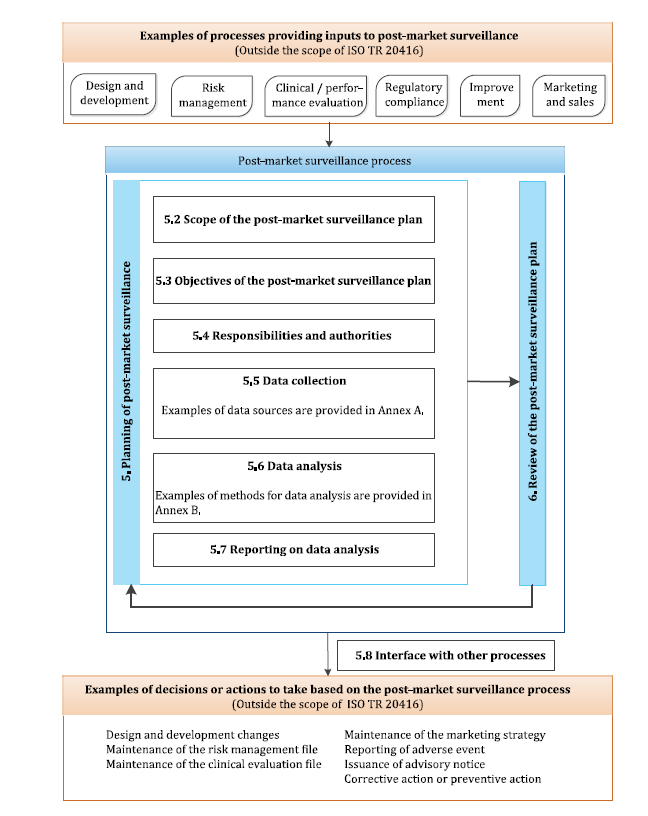
圖1. 上市后監督示例圖
如上圖所示,執行上市后監督,先得制定上市后監督計劃。計劃中需明確上市后監督的范圍、目的、職責和權限、數據來源、收集方式、數據分析方法、計劃的評審、依據評審結果確定或者改進計劃。
制定PMS計劃的目的應結合法規的要求及產品的特性,例如符合MDR要求的成熟的醫療設備其目的如下:
?設備設計是否有缺陷?
?是否有其他技術取代該設備(最先進的技術)或其他發展,例如 在工人安全或廢物處理方面?
?是否發生了事故或其他可報告的事件?
?設備的臨床應用是否有任何問題?
?用戶滿意嗎?
?設備是否有任何標簽外使用或誤用?
關于職責,應考慮合規負責人在PMS中的角色。同時,應考慮組織內其他成員以及與組織相關的經濟運營商如何協調合規負責人做好PMS數據的收集、分析和報告。
ISO TR 20416 附錄A 給出了常見的主動或者被動的數據來源。組織在參考這些來源的時候,因注意其可實施性。
ISO TR 20416 附錄B給出了一些數據分析方法。組織可選擇合適的方法對其收集的數據進行分析。
執行PMS活動,基于其輸出,可能涉及如下活動:
?如不良事件或非嚴重的事故趨勢發生變化,應及時向監管機構報告;
?監測到嚴重的事故或者嚴重的不良事件、新的不良事件等,因按相關規定向監管機構報告并基于調查和分析結果執行糾正和預防措施;
?執行設計變更以提高客戶滿意度或者控制產品風險;
?更新臨床評估,確保其受益大于風險、產品滿足其宣稱的安全和性能要求;
?更新風險管理文檔,確保綜合剩余風險可接受。