上市后臨床跟蹤PMCF
目的:明確器械預(yù)期的生命周期內(nèi)的臨床性能,被定義的風(fēng)險是否可以接受以及在實(shí)證的基礎(chǔ)上發(fā)現(xiàn)新出現(xiàn)的臨床風(fēng)險。
為什么需要進(jìn)行上市后臨床跟蹤?
?罕見并發(fā)癥及其他不良反應(yīng)只有在器械的廣泛使用或長期使用后才暴露出來;
?器械在整個生命周期中是否安全和有效?
?剩余風(fēng)險的可接受性是否可以接受,是否會出現(xiàn)新的風(fēng)險?

器械上市后臨床跟蹤PMCF的方法
1)將上市前臨床試驗(yàn)的隨訪時間延長
2)啟動新的臨床調(diào)查
什么情況下可以豁免上市后臨床隨訪試驗(yàn)?
1)當(dāng)器械中,長期的臨床有效期和安全性已經(jīng)從器械以往的使用過程中得到驗(yàn)證;
2)當(dāng)其他售后監(jiān)督信息能夠提供關(guān)于臨床風(fēng)險方面的數(shù)據(jù)。
MDCG 2020-7 Guidance on PMCF Plan Template
MDCG 2020-8 Guidance on PMCF Evaluation Report Template
上市后臨床跟蹤試驗(yàn)在下面情況下是強(qiáng)制的
1)創(chuàng)新的器械;
2)器械的設(shè)計適用癥及預(yù)期用途等發(fā)生重大的變化;
3)產(chǎn)品使用的風(fēng)險高;
4)針對高風(fēng)險的解剖部位/高風(fēng)險的人群;
5)出現(xiàn)了有關(guān)安全性和有效性方面新的信息;
6)當(dāng)上市前臨床評估時走的是等同性路徑(特別是高風(fēng)險產(chǎn)品!!)
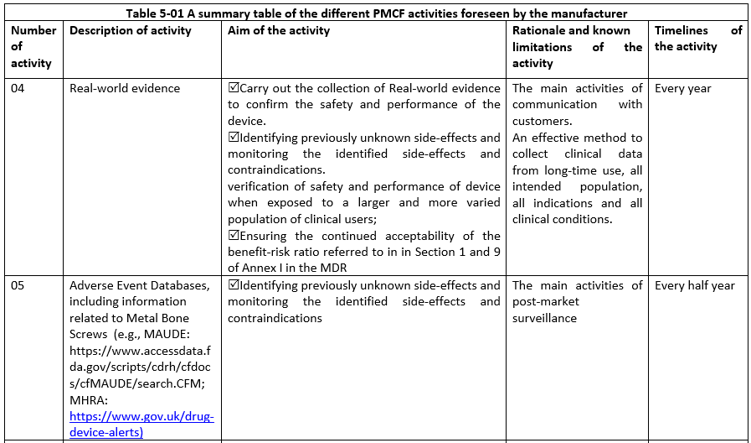
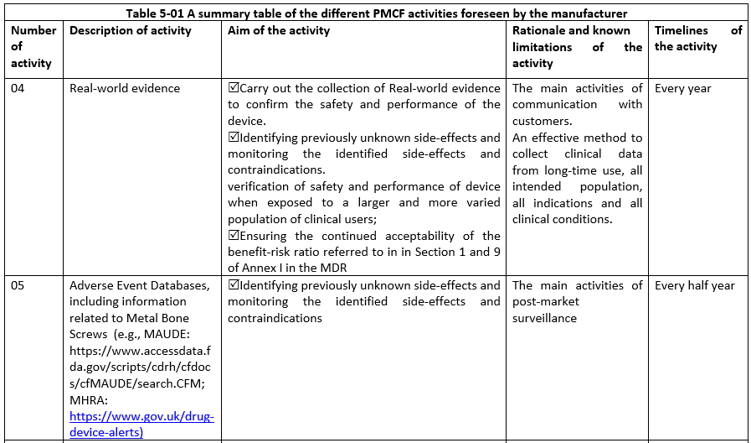
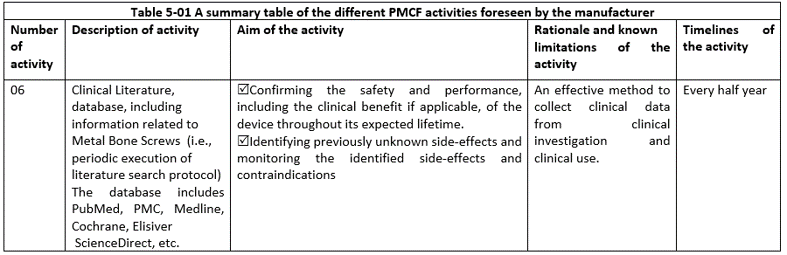
PMCF活動:投訴、客戶反饋、PMCF研究、真實(shí)世界數(shù)據(jù)、不良事件、文獻(xiàn)數(shù)據(jù)
真實(shí)世界數(shù)據(jù)(RWD)
是指來源于日常所收集的各種與患者健康狀況和/或診療及保健有關(guān)的數(shù)據(jù)。
患者隨訪調(diào)查



對于Ⅲ類器械和植入器械(非定制或研究器械),制造商應(yīng)起草一份安全和臨床性能總結(jié),該臨床和性能總結(jié)應(yīng)是擬定使用者及患者明白,并應(yīng)由公告機(jī)構(gòu)驗(yàn)證后通過Eudamed向公眾開放。
SSCP信息必須來源于CE技術(shù)文件,并且一致。SSCP應(yīng)該保持更新,如果PMCF和PSUR每年更新,則SSCP也應(yīng)更新,并且CE技術(shù)文件中相關(guān)內(nèi)容也應(yīng)同步更新。
SSCP應(yīng)客觀并充分總結(jié)有利和不利數(shù)據(jù)。
制造商應(yīng)在說明書或標(biāo)簽上列出SSCP的獲得地址。
SSCP應(yīng)翻譯成目標(biāo)銷售國的語言。
可讀性:醫(yī)生和患者都能看懂。SSCP應(yīng)該以有組織且明確的方式呈現(xiàn)。
SSCP的驗(yàn)證和上傳
對于Ⅲ類和Ⅱb植入器械(縫合線,吻合釘?shù)瘸猓?yīng)該每個器械都評審和上傳。
對于Ⅱa和Ⅱb植入器械(縫合線,吻合釘?shù)龋?yīng)按照抽樣規(guī)則評審SSCP,并將所有SSCP上傳。如果發(fā)證評審時沒審核的SSCP,需要在證書有效期內(nèi)的年審中評審,每年至少一個。
換證時的SSCP驗(yàn)證與首次認(rèn)證時要求一致。
SSCP由公告機(jī)構(gòu)NB上傳。
SSCP更新頻率和PSUR相同。
SSCP的內(nèi)容(不限于)
1)器械和制造商標(biāo)識,包括基本UDI-DI和SRN(如已發(fā)布),器械分類,器械命名方式,歐盟代表的名字和SRN,NB信息,首次CE認(rèn)證時間;
2)器械的預(yù)期用途,適用癥,禁忌癥和目標(biāo)人群;
3)器械描述,包括前一代或者變體的參考文件,和差別說明,以及附件、其他器械和其他產(chǎn)品等與該器械聯(lián)合使用的說明;
4)有關(guān)任何剩余風(fēng)險和不良影響、警戒和預(yù)防措施的信息;
5)附錄XIV中參考的臨床評價總結(jié)和上市后臨床跟蹤的相關(guān)信息;
6)可能的診斷或治療替代品;
7)為使用者提供的建議概況和培訓(xùn);
8)參考的協(xié)調(diào)標(biāo)準(zhǔn)和CS;
9)更新歷史:版本號和發(fā)行時間
Reference:MDR, Article 32
MDCG 2019-9 Summary of safety and clinical performance-A guide for manufacturers and notified bodies
歐盟MDR新法規(guī)下的PMCF