為什么說,看一個人懂不懂CE,就看其是否真的理解DOC在歐盟CE法規(guī)體系里的作用,或者是否理解歐盟為什么設(shè)置DOC這個東西。特別是在當(dāng)前,很多制造商以為MDR I類,IVDR Class A,及剛過去的IVDD others產(chǎn)品的歐盟準入就是“歐代注冊”的大氛圍下,其實隱藏的反而是整個業(yè)界缺乏對什么才是真正符合CE的內(nèi)涵的理解。
別看EU declaration of conformity只是短短一頁紙的內(nèi)容,但歐盟新醫(yī)療法規(guī)MDR / IVDR專門為其分配了一個附錄Annex IV來對其要求做規(guī)定。Annex IV是緊跟在Annex II和III技術(shù)文檔要求之后,在Annex V的CE Marking之前,可見其重要程度。
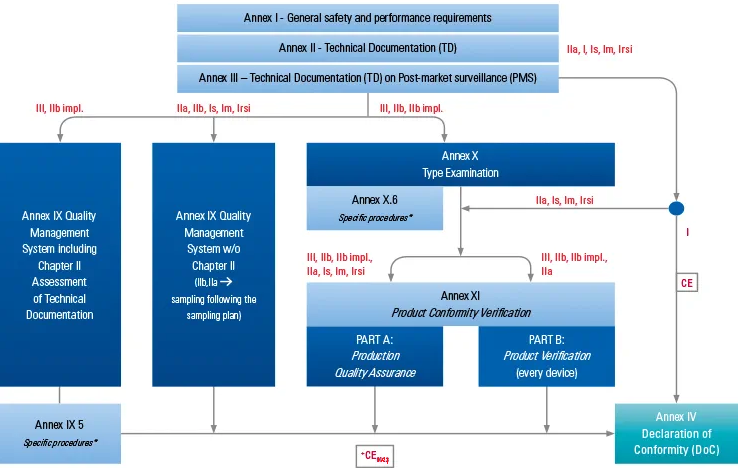
1. 歐盟符合性聲明是什么?
歐盟符合性聲明是任何醫(yī)療產(chǎn)品CE認證中的關(guān)鍵一環(huán),也是至關(guān)重要的一個文件,是在確認產(chǎn)品符合MDR新規(guī)之后,向外界提供的證明該商品符合歐盟器械法規(guī)的文件,在一些場合必須要出具該文件才能證明銷售權(quán)利。
2. MDR下的歐盟符合性聲明要求
MDR/IVDR新規(guī)中要求制造商必須為其商品簽署符合性聲明,簡稱為DOC。DOC在提交CE符合性申請時,通常與產(chǎn)品的技術(shù)文件一同出具,接受歐盟當(dāng)局的檢查。根據(jù)MDR文件的要求,我們可以看到一些硬性要求。在聲明中,制造商需說明已履行MDR法規(guī)所提及的內(nèi)容規(guī)范,并且制造商承諾不斷更新歐盟規(guī)范性聲明。至少提交附錄IV中出信息翻譯成歐盟規(guī)定用語以便于歐盟相關(guān)機構(gòu)進行查驗。起草聲明時制造商需承擔(dān)法規(guī)中所有涉及本醫(yī)療器械的責(zé)任要求。
3. MDR下的歐盟符合性聲明模板信息
參考Annex IV下的EU DOC必須包含如下信息:
1. 在第31條中所述的制造商的名稱、注冊商品名或注冊商標和SRN(如簽發(fā))及其授權(quán)代表(如適用)和注冊營業(yè)地點的聯(lián)系地址;
2. 由制造商自行負責(zé)簽發(fā)的歐盟符合性聲明
3. 附錄VI第C部分所所述的基本的UDI - DI;
4. 產(chǎn)品和商品名、產(chǎn)品代碼、目錄編號或其他明確的參考號,包括歐盟符合性聲明所涵蓋的器械的識別和可追溯性,如適當(dāng)照片以及其預(yù)期目的。除產(chǎn)品或商品名稱外,如第3點所述的基本UDI - DI提供允許識別和可追溯性信息;
5. 按照附錄VIII提出的規(guī)則,器械風(fēng)險等級;
6. 當(dāng)前聲明所涵蓋的器械符合本法規(guī)和其他相關(guān)的歐盟立法以及聯(lián)盟立法(規(guī)定發(fā)布歐盟符合性聲明的要求)(如適用);
7. 關(guān)于合格聲明所用的通用規(guī)范CS;
8. 如是由公告機構(gòu)評審頒發(fā)CE證的產(chǎn)品,公告機構(gòu)的名稱和標識號,所執(zhí)行的符合性評估程序的說明和所簽發(fā)的證書的標識;
9. 其他適用的其他信息;
10. 簽字人的聲明,地址和日期、簽字人姓名和職務(wù)、以及代簽人簽名。
在起草聲明時還應(yīng)注意,DOC是制造商的職責(zé),公告機構(gòu)不能提供起草聲明的服務(wù)。如果是從未了解過CE認證的人士來進行起草該聲明往往會出現(xiàn)許多問題,因此應(yīng)該尋求專業(yè)人士的咨詢幫助。
隨著歐盟更換醫(yī)療器械檢測標準,辦理CE認證的醫(yī)療器械出口商也隨之變多。對于缺少申請認證經(jīng)驗的人來說,通過MDR下的歐盟符合性聲明模板來減少申請的工作中的難度是一個不錯的選擇。
微珂提供專業(yè)的MDR/IVDR認證服務(wù),歡迎來電咨詢:
微珂醫(yī)藥擁有海內(nèi)外專業(yè)成熟的技術(shù)團隊、以及與機構(gòu)深度的戰(zhàn)略合作,服務(wù)于醫(yī)療器械企業(yè),為企業(yè)提供優(yōu)質(zhì)的定制化服務(wù),協(xié)助企業(yè)從產(chǎn)品技術(shù)要求編寫、產(chǎn)品檢測、臨床評價資料編寫與審核、申報與跟蹤,根據(jù)企業(yè)實際情況,進行質(zhì)量管理體系建立,幫忙企業(yè)從管理到產(chǎn)品各環(huán)節(jié)一站式服務(wù)!
微珂集團服務(wù)熱線:4001182826!