在全球新冠疫情(COVID-19)尚未完全平息之際,猴痘疫情異軍突起。八月初美國聯邦政府宣布進入公共衛生緊急狀態,以加強應對猴痘疫情。目前,美國已累計6600多人感染猴痘,是全球病例最多的國家。
美國宣布進入公衛緊急狀態,意味著美國政府將為此騰出資金和其他資源來對抗猴痘病毒。美國衛生與公眾服務部長貝塞拉(Xavier Becerra)說:“我們準備將應對這種病毒的反應提升到一個新的水平,我們敦促每個美國人認真對待猴痘。”白宮表示已經提供了超過110萬劑疫苗,并幫助將美國國內的診斷能力,提高到每周可做8萬次的測試。
美國聯邦政府暨FDA對于猴痘病毒的應對分為檢測,預防,和治療幾個方面。本文總結了目前FDA對于猴痘檢測的態度和猴痘檢測試劑的批準情況。
(1)FDA對于檢測試劑的批準
猴痘病毒是正痘家族的一種,正痘家族的其他成員還包括天花病毒,牛痘病毒等。在FDA的官方數據庫里面注冊的正痘檢測試劑一共有4款510(K),還有一款de Novo, 都是美國疾控中心(CDC)注冊的,也就是說到目前為止還沒有任何私營企業注冊過這個產品。
所有這幾款產品都是用“非天花正痘病毒實時 PCR 引物和探針組合試劑”來命名的, 實際上這幾種產品基本是同一種。顧名思義,產品是針對除了天花以外的正痘病毒家族,而不是單單猴痘病毒的。具體情況分析如下:
K053469
K053469是FDA最早批準的關于正痘家族的檢測試劑。試劑的申請人是美國疾控中心(CDC)。它采用實時PCR引物和探針組合,主要目的不是用于猴痘感染,而是用于監控天花疫苗接種時產生的不良反應,比如牛痘感染。這個試劑不能檢測天花病毒,也不能區別猴痘和牛痘病毒。產品于2005年獲得批準。
K181205
K181205是FDA于2018年9月20號批準的,試劑的申請人也是美國疾控中心(CDC)。同樣采用實時PCR引物和探針組合,用于監控天花疫苗接種時產生的不良反應,比如牛痘感染。
這個試劑和K053469幾乎一樣, 唯一的區別是采用了不同的原料,和更新了使用目的。當時的背景是擔心天花病毒可能被恐怖分子利用, 因此美國在小范圍內恢復了天花疫苗的接種。牛痘是天花疫苗的組成成分,可能會造成接種人感染, 因此FDA批準的這個試劑的主要目的也是用于探測牛痘病毒的感染。同樣的,這個試劑不能檢測天花病毒,也不能區別猴痘和牛痘。
K221658
時間轉眼到了偉大的2022年。猴痘病毒登上了舞臺。FDA于6月10日批準了一款新的檢測試劑K221658.
K221658的實質等同產品是上面提到的K181205. 事實上, 兩款產品基本一樣, 一些細小的區別表現在:
◆申報的目的是應對新型猴痘病毒而不是牛痘病毒。
◆產品使用的試劑和儀器有所改進
◆產品的性能數據在FDA網站上沒有公開,但是據內部消息,性能有一定的改進。
產品使用熒光探針,該探針由連接在寡核苷酸的5' 端的報告染料(FAM)和連接在 3' 端的猝滅劑 (BHQ1) 組成。探針識別位于正向和反向引物之間的特定目標序列。在 PCR 循環的延伸階段,Taq聚合酶的 5' 核酸酶會降解探針,導致染料與猝滅劑分離,從而產生熒光信號。在每個循環中,更多的染料分子從探針上裂解下來,從而在PCR 期間實時監測熒光強度。該測定中使用的 Taq 聚合酶在室溫下是無活性的,在95°C 時會被激活,從而最大限度地減少非特異性擴增產物的產生。
和以前兩款產品一樣,產品的申請人是美國疾控中心(CDC),產品只可以在國家響應實驗室網的成員實驗室(LRN實驗室)使用。這是經過專門認證的高質量實驗室,目前在47個州有68家實驗室。
K221834
兩周后的6月23日, FDA再次出手,批準了K221834. K221834和前面提到的K221658 是完全相同的產品, 只不過把授權實驗室從國家響應實驗室網的成員實驗室(The Laboratory Response Network)擴大到疾控中心特許實驗室(CDC designated laboratories.),目的在于擴大總體測試能力。
目前全美國有四家CDC特許實驗室可以運行這個測試, 很快會有第五家實驗室獲得CDC特許。
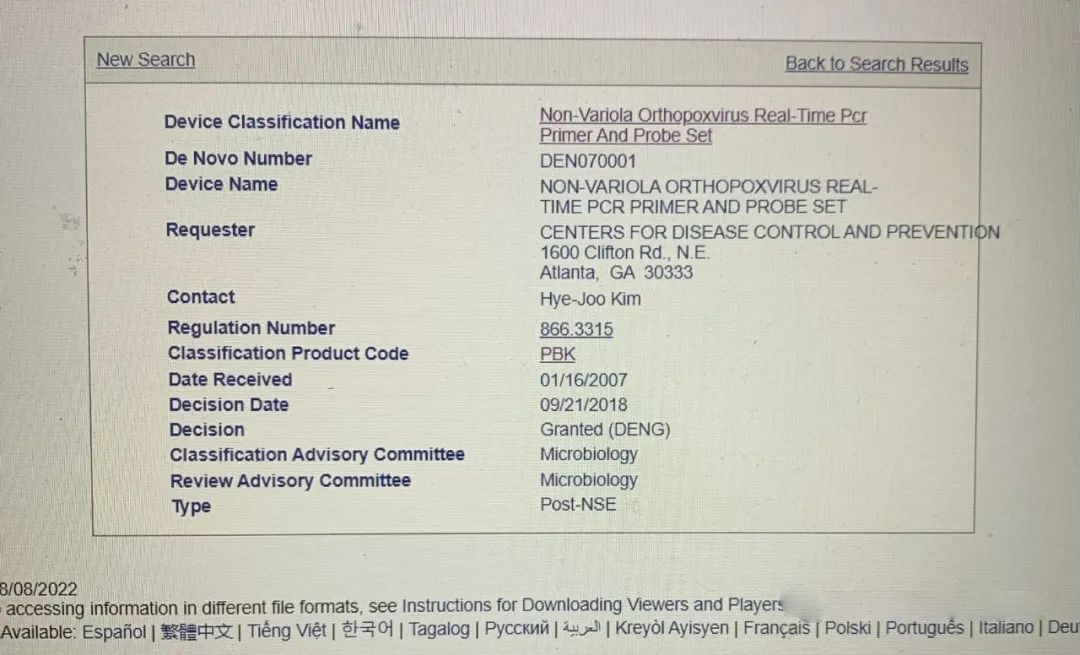
De Novo DE070001
De Novo是美國創新器械的流程。但是CDC提交的這款DE070001是一個奇怪的存在。它是在2007年由疾控中心(CDC)提交的,卻在2018年才被批準,批準日期是2018年9月21號,也就是上面提到的K181205的批準日期的第二天。(見下圖) 目前FDA網站上沒有這個產品的任何信息,FDA 和CDC在討論猴痘病毒檢測的時候也從來沒有提到這款試劑。
實驗室自研檢測試劑
除了上述FDA批準的試劑以外,FDA在7月27日的市政廳會議上再次證實,FDA允許檢測實驗室使用自己研發的猴痘檢測試劑或檢測方法, 前提是檢測方法經過完整的方法驗證,并且只在本實驗室使用。 這樣開發出來的檢測方法不需要FDA的批準和備案。
FDA這樣做的目的也是為了擴大檢測能力。FDA在新冠疫情初期也采用了同樣的做法。
猴痘樣本的采集
7月15日, FDA發布安全通報,在猴痘樣本的采集時候,要求只能采用病變組織的拭子樣本。目前的臨床證據不支持其他的樣本采集方式,比如唾液和血液。病變組織的干拭子,VTM 中的病變組織拭子或結痂是可以接受的。采樣拭子可以是經過滅菌的塑料材質(polyester,nylon等)
解讀
由于猴痘病以前在美國很少見,CDC 開發的試劑是目前唯一經FDA 510(k) 批準的檢測方法。該檢測方法流程比較復雜, 對操作人員的專業要求較高,需要經過培訓才能上崗,所以目前的使用僅限于國家響應實驗室網的成員實驗室 (LRN)或CDC特許實驗室。
目前美國市場上用于猴痘檢測是試劑雖然有4個510(K)號碼和一個De Novo號碼,但實際上都是疾控中心(CDC)開發的同一款產品。這款產品其實有他的缺陷。由于它不能區別猴痘, 牛痘, 或其他正痘家族的病毒,也不能用于檢測天花病毒, 所以不能用于確診猴痘,而只能作為主要診斷手段之一。
目前美國市場上還沒有FDA批準的商業檢測試劑,主要原因是以前美國市場上的需求不高,開發技術難度較大(比如CDC的方法一直無法區分猴痘和牛痘),以及FDA缺乏政策支持的力度(相對于新冠檢測而言)。
現在美國宣布進入公衛緊急狀態,FDA可能會調整對于開發猴痘檢測試劑的政策支持力度,讓我們拭目以待。
是否在美國申報猴痘試劑是一個商業決定, 取決于對猴痘流行模型的預測。目前CDC開發的試劑已經可以滿足當下美國的檢測需求,據曼度醫械咨詢估算,目前每天的實際檢測量小于最大檢測能力的50%。當然這個情況也可能會隨著猴痘的進一步流行而改變。
對于有興趣開發猴痘試劑的公司,猴痘的質控樣可以在美國國家標準實驗室(NIST)或一家名叫Twist Biosciences的公司購買。
微珂提供專業的FDA注冊服務,歡迎來電咨詢:
微珂醫藥擁有海內外專業成熟的技術團隊、以及與機構深度的戰略合作,服務于醫療器械企業,為企業提供優質的定制化服務,協助企業從產品技術要求編寫、產品檢測、臨床評價資料編寫與審核、申報與跟蹤,根據企業實際情況,進行質量管理體系建立,幫忙企業從管理到產品各環節一站式服務!