可能大家都知道,進入歐盟市場,除了CE認證,還需要在當地指定一名歐盟授權代表。醫療器械單一審核計劃 (MDSAP)涉及到的五國,對授權代表又是怎么規定的呢?筆者梳理了各國要求,匯總成如下表格:
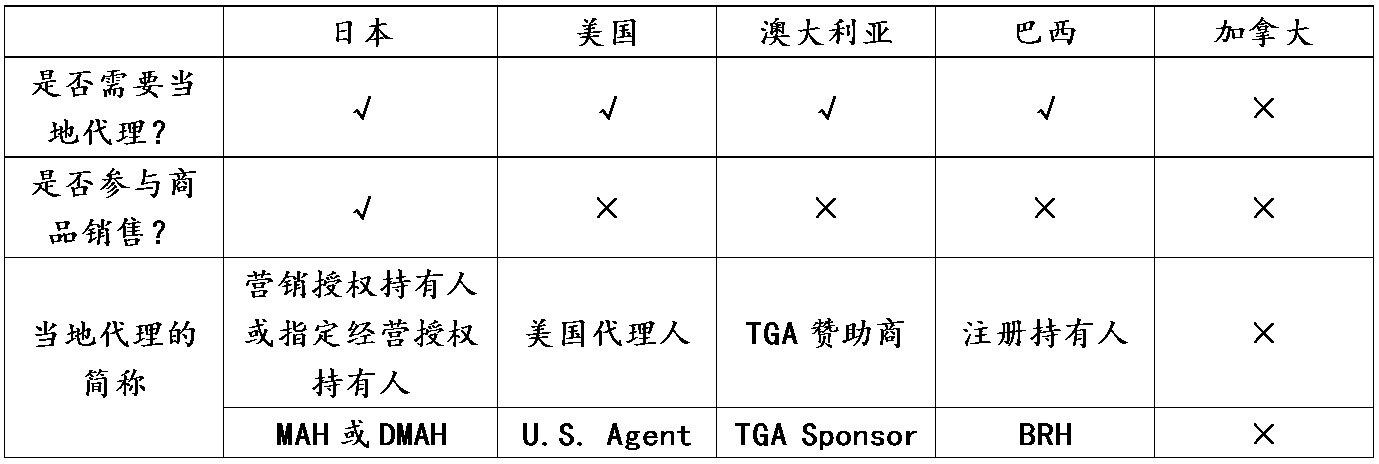
首先,政策最友好的是加拿大。加拿大作為不需要指派當地代表的國家,對很多外國制造商非常具有吸引力。
其次,政策較為接近的是美國、澳大利亞和巴西。不在這三國的醫療器械和IVD制造商必須選擇一個國內代表。盡管在簡稱上各有不同,澳大利亞,被稱為TGA贊助商;巴西,被稱為注冊持有人;美國,被稱為美國代理人。但這三國的授權代表有著一些共同的特點。若是你進入這三國的醫療器械市場,一般性都推薦選用不參與商品銷售的第三方”代理商”來承擔授權代表的職責。主要是雇傭一個獨立的授權代表,而不是一個分銷商,可以更好的在任何時候改變分銷商。而且,授權代表一般要求是實體公司,不能只是郵箱、語音電話,或者作為國外工廠代理人的個人地址根本就不存在的場所。另外一個共同點是都作為連接主管當局和國外工廠之間的紐帶,負責緊急情況和日常事務交流。不過,在具體需要承擔的職責上,這三個國家也有細微的不同。在有些國家,比如巴西,注冊持有人(BRH)除了充當制造商與巴西國家健康監督局(ANVISA)之間的聯絡人,還負責制造商在巴西的醫療器械注冊,對經銷商產生進口授權書等職責。
日本的政策則與我國對進口醫療器械的政策有些類似。制造商在日本進行的商業活動需要通過注冊指定的代理人進行,也就是說日本的這個授權代表既承擔監管責任,又從事與產品有關的商業活動。醫療器械上市許可持有人分為營銷授權持有人(Marketing Authorization Holder,MAH)和指定營銷授權持有人(Designated Marketing Authorization Holder,DMAH)。MAH和DMAH必須都是位于日本本土的實體,作為產品代表向日本市場進口或銷售醫療器械,以確保其可以承擔全部質量管理責任。因此,外國醫療器械制造商需要指定MAH或DMAH來管理其在日本的產品注冊、銷售并與日本醫藥品醫療器械綜合機構(PMDA)聯絡,履行日本境內的質量控制職責。
微珂提供專業的MDSAP認證服務,歡迎來電咨詢:
微珂醫藥擁有海內外專業成熟的技術團隊、以及與機構深度的戰略合作,服務于醫療器械企業,為企業提供優質的定制化服務,協助企業從產品技術要求編寫、產品檢測、臨床評價資料編寫與審核、申報與跟蹤,根據企業實際情況,進行質量管理體系建立,幫忙企業從管理到產品各環節一站式服務!