什么情況下可以豁免MDSAP認證審核?今天小編就在這里為大家進行一個解答!
eSTAR背景
2020年2月,為了支持僅以電子格式提供的上市前通知[510(k)]提交的過渡,CDRH開發并開始試行電子提交模板和資源(eSTAR)的使用。
2021年11月29日, FDA在官網上發布了eSTAR PDF Template,以供醫療器械提交者自愿使用。該模板通過標準化的格式,使提交者可以確保提交的內容完整,FDA可以更高效地進行審查。
目前,eSTAR已更新到版本2.0(2022年10月07日發布),并且只接受510(K)及De Novo的提交(如下圖):

如何使用eSTAR提交文檔
1)下載正確的 eSTAR PDF 模板并保存,然后再在 Adobe Acrobat Pro 中打開。
2)閱讀、理解并按照 eSTAR PDF 模板中各個模塊的介紹、密鑰、常見問題解答和版本歷史等,并按照相應說明進行操作。
3)填寫eSTAR PDF 模板。該模板僅用于建立文件,而不是提交申請。模板末尾的說明提供了有關如何提交申請的說明。
eSTAR文件與eCopy的差別
eSTAR文檔仍是建立在原先eCopy的基礎上的,所需的內容基本一致,主要變化在于提交者無需在eSTAR中提供使用Indication for use頁面(FDA 3881表格)、CDRH Premarket Review Submission Cover Sheet(FDA 3514表格)或符合性聲明(如適用),因為所有這些都內置于eSTAR PDF中。此外,如果選擇使用eSTAR創建510(k)摘要,則無需在eSTAR中提供額外的510(k)摘要。
eSTAR文件的填寫
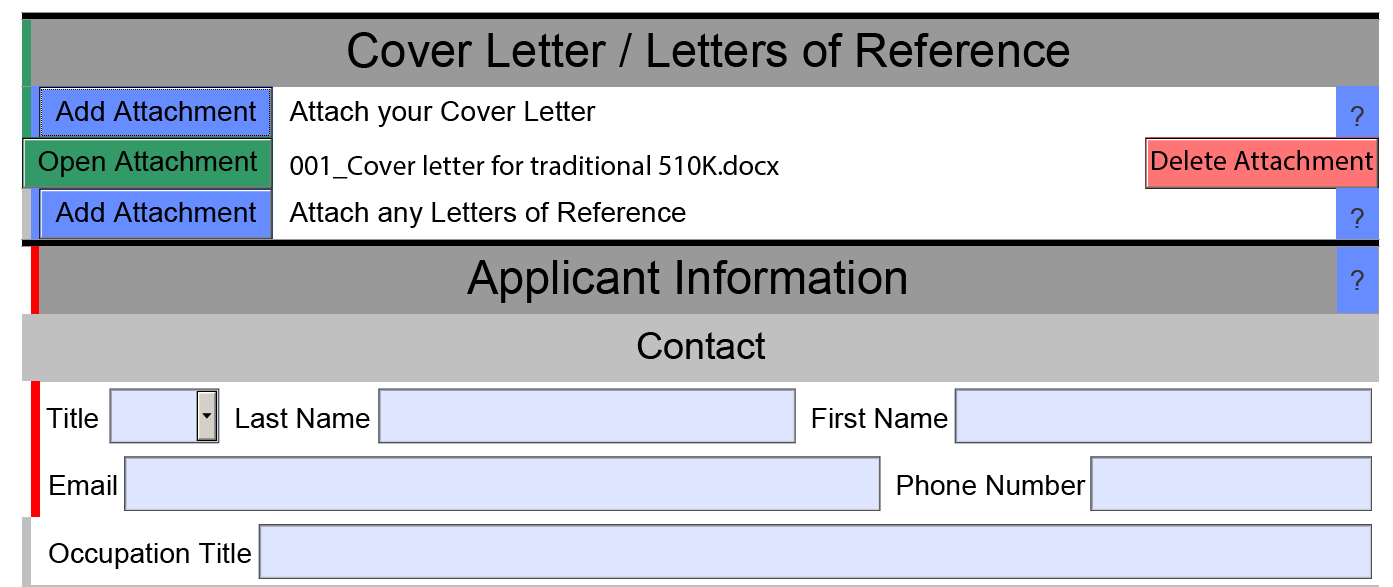
目前的填寫方式還是比較便捷的,各個模塊右邊的“?”圖標中都對當前所需的文件有介紹和提示。
填完的部分在左邊會顯示為綠色,沒填的為紅色。針對不同性質的產品(如滅菌,有源等),在選擇相關特性后整個模板也會做出相應的更新。正確完成eSTAR 文件后,頂部的狀態消息會顯示為“eSTAR Complete”。
eSTAR審核時長
在FDA收到eSTAR提交后,鑒于使用依據eSTAR PDF模板準備的提交文件應為完整的提交,預計eSTAR提交不會經過拒絕接受(RTA)程序。但是,FDA會對eSTAR采用病毒掃描和技術篩選過程。
FDA將在收到510(k)后60天內做出最終決定,但如果eSTAR提交時仍不完整,FDA將通過電子郵件通知提交者并識別不完整的信息,提交將被暫停180天或直到向FDA提交完整的替代eSTAR。
eSTAR運行時間
目前,使用eSTAR是自愿的。但是,自 2023 年 10 月 1 日起,所有的 510(k) 提交,除非是豁免產品,否則必須使用 eSTAR進行電子提交。