醫療器械進入日本市場的注冊登記流程較為復雜,且存在著語言方面的障礙,因此,日本一直被醫療器械制造商認為是極具挑戰性的市場之一。為幫助國內醫療器械制造商順利進入日本市場,微珂將為為國內醫療器械制造商提供產品設備出口日本的服務。
今天向大家介紹一下醫療器械PMDA日本市場準入的基本內容。
01法律法規
日本藥品和醫療器械管理法律法規制度是《Act on Securing Quality, Efficacy and Safety of Products Including Pharmaceuticals and Medical Devices》(簡稱:《藥機法》)。
該法由原《藥事法》變更而來。 法規由《藥機法》、《藥機法實施令》、《QMS省令》、公告、通知等構成。
02主管機關
日本藥品和醫療器械的主管機關為日本厚生勞動省(MHLW)和行政法人醫藥品醫療器械綜合機構(PMDA)。
03醫療器械的分類
1一般醫療器械(ClassⅠ)
由日本厚生勞動省大臣在聽取“藥事和食品衛生審議會”的意見后進行指定,這類醫療器械在出現副作用或功能損害時,對人的生命和健康影響的風險很小。一般指除高度管理醫療器械和管理醫療器械以外的醫療器械。
2管理醫療器械(ClassⅡ)
由日本厚生勞動省大臣在聽取“藥事和食品衛生審議會”的意見后進行指定,指除高度管理醫療器械以外的醫療器械。這類醫療器械在出現副作用或功能損害時,有可能影響人的生命和健康,需要進行合適的管理。
3高度管理的醫療器械(ClassⅢ、ClassⅣ)
這類醫療器械由日本厚生勞動省大臣在聽取“藥事和食品衛生審議會”的意見后指定。一般是指在出現副作用或功能受損的情況下(僅限于按照預定使用目的正確使用時)會對人的生命和健康產生嚴重影響,對這類設器械必須進行合適的管理。
04醫療器械的認證模式
1備案、認證和批準

2具體注冊審核流程
所有打算將其設備出口到日本的外國制造商都必須在厚生勞動省 (MHLW) 進行注冊備案。這種注冊備案程序被稱為外國制造商注冊(FMR),以前被稱為“外國制造商認證(FMA)”或“外國制造商認證(AFM)”。
根據PMD Act& 第169號法令IS0 13485日本醫療器械注冊審核流程如圖所示:
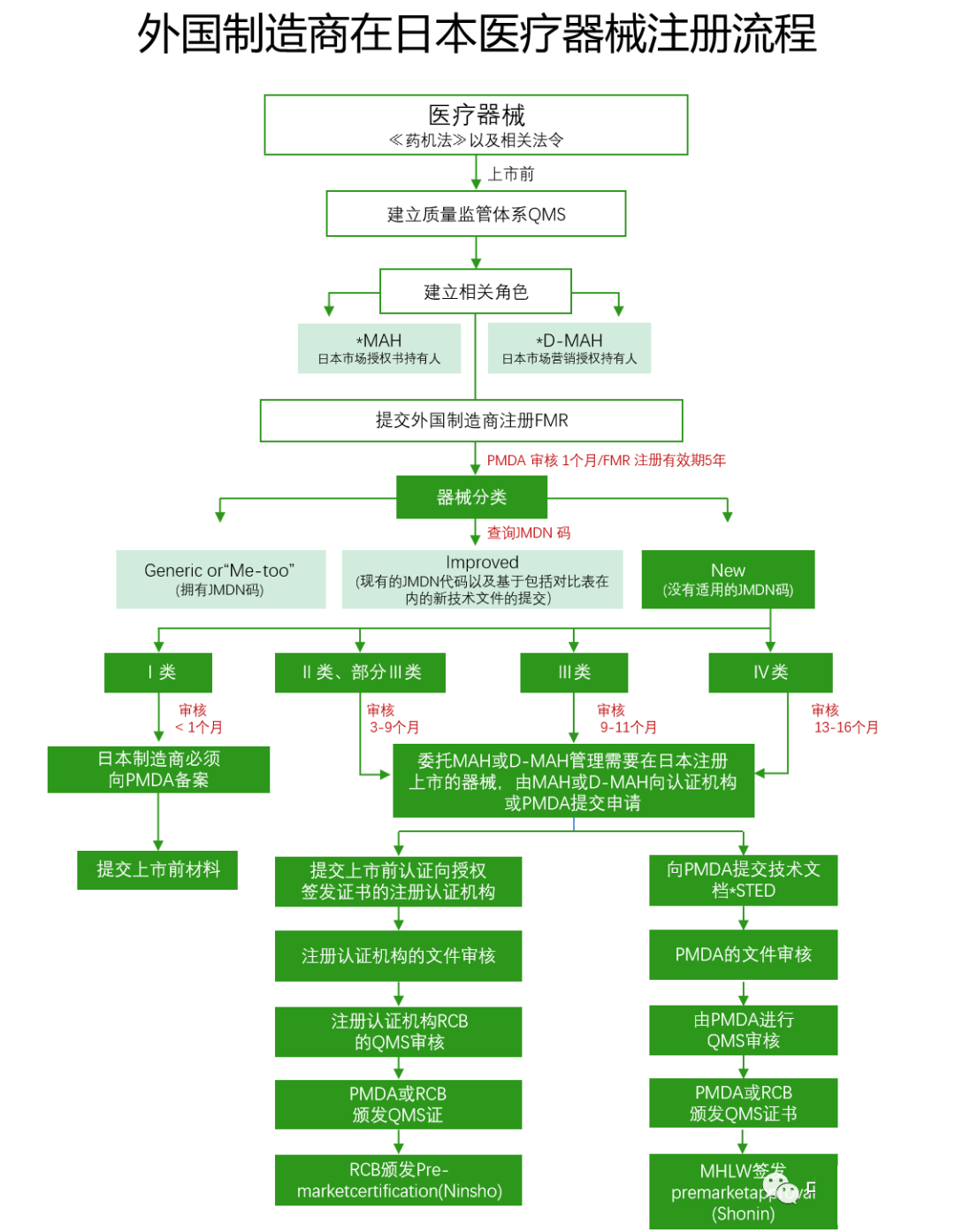
05重點關注
1市場授權持有人(MAH)/市場營銷授權持有人(D-MAH)
外國制造商必須指定日本國內市場授權持有人,這是作為在日本國內銷售醫療器械的首要條件。MAH對日本市場上的醫療器械產品從批準、認證和備案,到上市后的安全管理負有最終責任,并對問題產品實施召回,且有義務管理和監督產品生產。除MAH外,PMDA允許外國制造商指定市場營銷授權持有人,即D-MAH。D-MAH不擁有產品的注冊和證書/批準的控制權,可視作為外國制造商駐日代表。
2STED摘要(注冊資料)
STED摘要具體包括以下內容:
01產品規格
02穩定性和保質期數據
03性能測試數據
04風險分析
05臨床數據
06制造(過程,監督,滅菌)
07遵守適用的標準和基本原則
08開發歷史記錄(先前的設備版本,全局授權)
3質量管理體系(QMS)審核
QMS審核是由醫藥品與醫療器械局(PMDA)或某一家注冊過的認證機構(RCB)來執行的。QMS審核所需資料有質量手冊、程序文件、ISO 13485證書、組織結構圖、制造工程圖、制造設備等。QMS審核范圍包括制造銷售商(MAH)、醫療器械的設計、生產制造相關的所有場所。是否需要進行QMS的實地調查,由認證機構判定是否有此必要性。
04多法規要求
外國制造商的醫療器械產品進入日本市場,還需要同時滿足其他法規的要求,如電安法、電波法。
