當地時間4月16日,歐盟MDCG(醫療器械協調小組)針對體外診斷器械發布指導文件MDCG 2024-4《2017/746法規下體外診斷醫療器械性能研究安全性報告》及報告模板,總結報告(MDCG 2022-9)的模板也于同日更新。
在數字化和全球化、互聯網日益普及的當下,醫療器械,特別是體外診斷器械的安全性與性能評價日益受到重視。由于其直接關系到患者的疾病診斷與治療方案選擇,因此其安全性能更是不容忽視,微珂將對該指南進行解讀,以幫助廣大體外診斷企業更深入了解出海的需求。
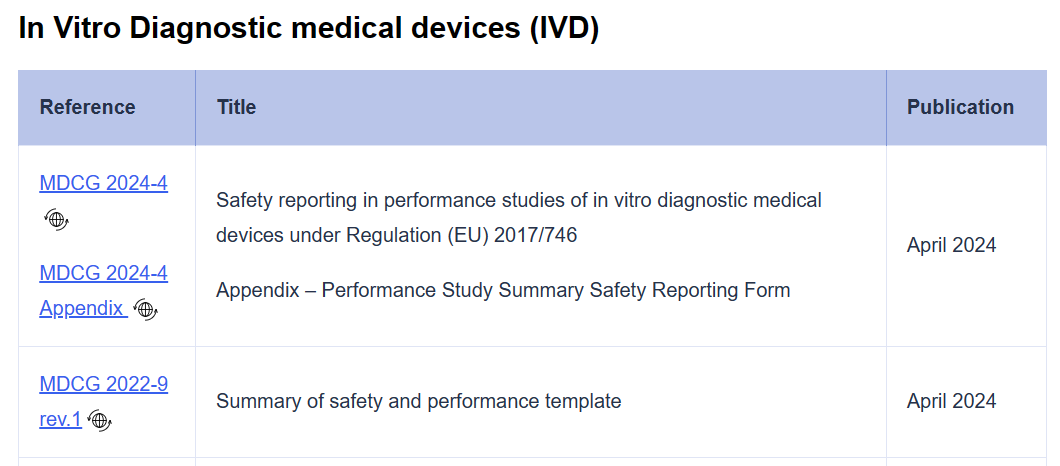
?MDCG 2022-9 Rev.1 SSP(Summary of safety and Performance)模板
本次主要更新內容如下:

● 在介紹部分,澄清何時應向患者提供SSP,刪除腳注3;
● 腳注2更新,與 MDCG 2019-9 rev.2 一致;
● 在section 1A部分,把1.7 Indication whether it is a device for near-patient testing and/or a companion diagnostic挪至2.3;
● Section 1A, 1B 和 2部分的第2點標題修改為“Intended purpose and other indications”
本次更新的內容并不多,但還是要提醒各位適時更新相關產品的SSP。
?最新指南MDCG 2024-4
該指南指出:IVD器械性能研究的安全報告應根據IVDR Article 76(2)的要求執行,發起人或其法定代表人必須立刻向正在進行性能研究的所有成員國報告以下所有事項:
● 任何與器械、對比器械或研究程序有因果關系的嚴重不良事件,或存在合理可能的因果關系;
● 如果沒有采取適當的行動、沒有進行干預或情況不佳,可能導致嚴重不良事件的任何器械缺陷;
上述兩點中提到的任何事件的任何新發現。
需要注意的是:由于IVDR(體外診斷器械法規)第69條提及的電子系統, 特別是EUDAMED及其用于臨床調查和性能研究的模塊, 在IVDR認證申請之時尚未全面投入使用并功能完備。
因此本指南詳細闡述了在沒有EUDAMED模塊支持或該模塊功能尚未完全健全的情況下,進行性能研究時應遵循的安全報告程序,適用報告的方法如下:

向歐盟所有國家主管當局報告事件的時間表如下:
● 對于所有表明死亡、重傷或嚴重疾病迫在眉睫的風險,并且需要立即采取補救措施或新發現的事件,報告截止日期是贊助商意識到新的可報告事件或與已報告事件相關的新信息后2個自然日內。
● 對于IVDR第76(2)條規定的所有其他事件或表明新發現或更新的事件,報告截止日期為贊助商意識到新的可報告事件或與已報告事件相關的新信息之日起7個自然日。
此外,申辦者必須有一個可報告事件的系統,以確保調查員立即向申辦者報告相關事件,最遲相應時間應不遲于了解該事件后的 3 個自然日。除上述內容之外,MDCG 2024-4 指南還包括了有關報告表格、定義、縮寫和傷亡評估的更多詳細信息。